
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Максимальное заполнение энергетических уровней и подуровней
|
|
|
|
Составление электронных формул по двум квантовым числам.
| n | N = 2n2 | ℓ | N = 2(2ℓ + 1) | Запись электронного состояния |
| 0(s) | 1s2 | |||
| 0(s) 1(p) | 2s2p6 | |||
| 0(s) 1(p) 2(d) | 3s2p6d10 | |||
| 0(s) 1(p) 2(d) 3(f) | 4s2p6d10f14 | |||
| 0(s) 1(p) 2(d) 3(f) | 5s2p6d10f14 | |||
| 0(s) 1(p) | 6s2p6 |
1. Чтобы правильно составить электронную формулу элемента, нужно определить его положение в таблице Менделеева. Z - заряд ядра, А = Z + N; ē = Z.
2. n – главное квантовое число и, значит, число энергетических уровней, соответствует № периода.
3. № группы соответствует числу валентных электронов (участвующих в образовании связей), причём, если это главная подгруппа (А), то все валентные электроны находятся на верхнем энергетическом уровне. Если это побочная подгруппа, то на внешнем энергетическом уровне находятся 1 или 2 валентных электрона, остальные находятся на предвнешнем энергетическом уровне.
Пример: 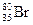 ; n = 1,2,3,4; VII A; z = 35;
; n = 1,2,3,4; VII A; z = 35;  = 35;
= 35;  = 45; ē = 35.
= 45; ē = 35.
Br°: 1s22s2p63s2p6d10 4s2p5 - на последнем энергетическом уровне, находятся валентные электроны.
У десяти элементов побочной подгруппы наблюдается проскок электронов (Cu, Au, Ag, Mo, Cr, Nb, Ru, Rh, Pt, Pd).
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 286; Нарушение авторских прав?; Мы поможем в написании вашей работы!