
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периодический закон и периодическая система элементов
Свойства элементов находятся в периодической зависимости от заряда ядра их атомов.
1. Радиусы атомов. В пределах периода с увеличением порядкового номера элемента, размеры атомов уменьшаются, т. к. увеличивается положительный заряд ядра, а количество энергетических уровней остаётся постоянным. Чем больше заряд ядра, тем сильнее электроны притягиваются к ядру, поэтому радиус атома уменьшается.
В пределах группы, с увеличением порядкового номера, размеры атомов возрастают, т. к. несмотря на увеличение заряда ядра, увеличивается количество энергетических уровней и ослабляется притяжение электронов к ядру.
Радиусы ионов, по сравнению с радиусами атомов могут увеличиваться или уменьшаться, в зависимости от того, принимает атом электрон, или отдаёт.
2. Энергия ионизации или DНион. это то количество энергии, которое необходимо затратить, чтобы оторвать электрон от невозбуждённого атома и удалить его за пределы взаимодействия.
DНион. > 0, причём, каждый последующий электрон отрывается труднее
DН1 < DН2 < DН3 <…< DНn
Величина DНион. характеризует способность элемента отдавать электроны, т. е. характеризует его восстановительные свойства. Чем меньше DНион., тем выше восстановительные свойства элементов. В пределах периода с уменьшением радиуса атомов энергия ионозации увеличивается, а в пределах группы с увеличением радиуса атомов энергия ионизации уменьшается.
3. Энергия сродства к электрону - это энергия, которая выделяется при присоединении электрона к невозбуждённому атому, молекуле или радикалу.
Э + е → Э-, DН < 0 - процесс экзотермический.
В периодах слева направо сродство к электрону увеличивается, а в пределах группы сверху вниз сродство к электрону уменьшается, т. к. увеличивается радиус атома.
Сродство к электрону характеризует окисляющие свойства элемента, т. е. чем больше сродство к электрону, тем более сильным окислителем является элемент. Самым сильным окислителем является F (фтор):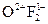 .
.
4. Электроотрицательность. Чтобы учесть и DНион. и DНср-ва, вводят понятие электроотрицательности.
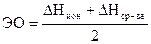 .
.
Электроотрицательность (по Полингу) это способность атома, связанного в молекуле и ионе, притягивать к себе электроны, участвующие в образовании связей.
Вводится шкала электроотрицательности по Полингу:
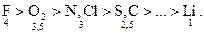
В пределах периода электроотрицательность возрастает слева направо. А в пределах группы электроотрицательность уменьшается сверху вниз.
5. Кислотно-основные свойства оксидов и гидроксидов.
В пределах периода, слева направо возрастают кислотные свойства оксидов и гидроксидов. Рассмотрим, например III период:
NaOH Mg(OH)2 Al(OH)3
щёлочь н/р в воде основание амфотерный гидроксид
H2SiO3 H3PO4 H2SO4 HClO4
слабая кислота средней силы кислота сильная кислота очень сильная кислота
В пределах группы возрастают основные свойства оксидов и гидроксидов. Возьмём IV группу, главную подгруппу:
H2CO3 - кислота;
H2SiO3 - не растворимая в воде кислота;
H2GeO3 ≡ Ge(OH)4 - амфотерный гидроксид, с преобладанием кислотных свойств;
H2SnO3 ≡ Sn(OH)4 - амфотерный гидроксид;
Pb(OH)4 - амфотерный гидроксид, с преобладанием основных свойств.
6. Окислительно-восстановительная способность элемента. См. п. 2 и 3.
|
|
Дата добавления: 2014-01-06; Просмотров: 253; Нарушение авторских прав?; Мы поможем в написании вашей работы!