
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость скорости химической реакции от температуры
|
|
|
|
Зависимость скорости химической реакции от температурыопределяется правилом Вант-Гоффа и уравнением Аррениуса.
Правило Вант-Гоффа: при увеличении температуры на каждые 100 скорость химической реакции возрастает в 2-4 раза.
Математически это запишется следующим образом:
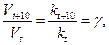 (7)
(7)
где: Vt и kt – скорость и константа скорости химической реакции при температуре t; Vt+10 и kt+10 – скорость и константа скорости химической реакции при температуре t+10; g – температурный коэффициент скорости химической реакции; для большинства реакций значения g = 2 ÷ 4.
В общем случае, когда температура процесса изменилась на Dt, уравнение (7) можно преобразовать к виду
 . (8)
. (8)
Уравнение Аррениуса. Уравнения (7) и (8) лишь приближенно оценивают зависимости V = f(t) и k = f(t). Функциональная зависимость константы скорости химической реакции (скорости химической реакции) от температуры была установлена шведским ученым Св. Аррениусом (1889 г.). Она выражается уравнением, названным в его честь уравнением Аррениуса:
k = A e-Ea/RT, (9)
где: А – предэкспоненциальный множитель; ЕА – энергия активации химической реакции.
А и ЕА являются важными характеристиками каждой химической реакции. Выясним физический смысл этих величин.
Предэкспоненциальный множитель
А = р·z, (10)
где z – число соударений молекул реагирующих веществ в единице объема за единицу времени; р – стерический (вероятностный) фактор, учитывает влияние пространственной ориентации молекул на скорость реакции (или константу скорости). Значения р = 10-9 ÷1. Малые значения р отвечают реакциям между сложными по своей структуре органическими соединениями.
Энергия активации химической реакции. Не все сталкивающиеся молекулы взаимодействуют с образованием продуктов реакции, а только те активные молекулы, которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных молекулах, создав возможность образования новых молекул.
|
|
|
Например, при химическом взаимодействии: H2 + I2 = 2HI должны разорваться связи Н-Н и I-I и образоваться связи Н- I. В некоторый момент времени возникает переходное состояние, когда одни связи не полностью разорвались, а другие уже начали формироваться. Такой нестабильный ассоциат называется активным (активированным) комплексом. Его образование можно представить следующей схемой:
Н I Н · · · I Н-I
| + | → ∶ ∶ →
Н I H · · · I Н-I
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 312; Нарушение авторских прав?; Мы поможем в написании вашей работы!