
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет эквивалентных масс
|
|
|
|
Эквивалент
Атомы и молекулы вступают друг с другом в химическое взаимодействие в
определенных количественных соотношениях, названных стехиометрическими. Выражение их коэффициентов в химических уравнениях называют стехиометрическими коэффициентами.
В основе стехиометрии (количественные соотношения) лежат четыре закона:
1) закон сохранения массы: масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции
2) закон постоянства состава: соотношения между массами элементов, входящих в состав данного соединения, постоянны и не зависят от способа получения этого соединения
3) закон кратных отношений: если 2 элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся на одну и ту же массу другого элемента, относятся друг к другу как небольшие целые числа
4) закон эквивалентов: вещества реагируют и образуются в количествах, пропорциональных их эквивалентам.
Эквивалент - это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода или в окислительно–восстановительной реакции одному электрону; например,
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
трем реагирующим частицам H2SO4 соответствуют две частицы Al(OH)3, следовательно, одному иону водорода эквивалентна одна треть частицы Al(OH)3
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
1 эквивалент MnO4- равен 1/5 этого иона
1/3 и 1/5 в данных примерах называют фактором эквивалентности. Единицей количества эквивалента является моль. Масса одного эквивалента - эквивалентная масса Мэкв.
Мэкв = fэкв . М (М - молярная масса).
в кислотно-основных реакциях:
для кислот:
 , где n - число ионов водорода в молекуле кислоты
, где n - число ионов водорода в молекуле кислоты
|
|
|
для оснований:
 , где n - число гидроксогрупп (ОН-) в молекуле основания
, где n - число гидроксогрупп (ОН-) в молекуле основания
для оксидов и солей:
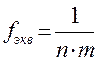 , где n - число катионов в молекуле, m - степень окисления катиона
, где n - число катионов в молекуле, m - степень окисления катиона
в окислительно-восстановительных реакциях:
 где n - число электронов данного иона (элемента), участвующих в реакции
где n - число электронов данного иона (элемента), участвующих в реакции
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 634; Нарушение авторских прав?; Мы поможем в написании вашей работы!