КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Простые вещества
Н ат.


 0
0
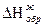

 газ
газ

 жидк.
жидк.
кристал.
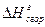
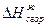
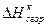
 |
Продукты сгорания
Примеры:
1. Энергия связи
Для расчета энергии связи Е, надо знать теплоту образования газообразного соединения из газообразных атомов. Эта величина называется атомарной теплотой образования ΔНат. Для ее определения нужно знать теплоты диссоциации простых веществ и теплоту образования соединения. Рассмотрев молекулу Н2О, построим энтальпийную диаграмму для расчета энтальпии атомизации ΔНат (Н2О) г.
Н, ккал
 200 2Н(г) + О(г)
200 2Н(г) + О(г)
 |
 ½(ΔНдисс)О2
½(ΔНдисс)О2


 100
100
(ΔНдисс)Н2 (ΔНат)Н2О
 |
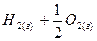
 0
0
Н2О(г)
 |  |
 100
100
Для определения ΔНат нужно знать теплоту диссоциации простых веществ и теплоту образования соединения
ΣHi =0
(ΔНат)Н2О = (ΔНдисс)Н2 + ½(ΔНдисс)О2 – (ΔНобр)Н2О = (104,2 + 59,2) – (-57,8) = =221ккал/моль.
Е О-Н = 0,5(ΔНат)Н2О = 110,6 ккал
2. Теплота гидратации.
Расчет теплоты гидратации может быть осуществлен на основании термохимических циклов.
Для металлов надо знать:
- теплоту сублимации ΔНсубл (ΔНвозг)
- теплоту ионизации ΔНиониз
|
Zn0(кр) + ∞ H2O = Zn2+(р-р) + 2 e
Н, ккал Zn2+(г)

 800
800
 600
600
 400
400
I =ΔНиониз ΔНраств
 200 Zn(г)
200 Zn(г)

 ΔНвозг Zn(к)
ΔНвозг Zn(к)
|


 0 ΔНгидр Zn2+(p-р)
0 ΔНгидр Zn2+(p-р)

3. Зависимость теплоты растворения H2SO4 в воде от количества молей Н2О
H2SO4(ж) +6H2O = H2SO4∙6H2O ΔН0298 = -12,88 ккал
H2SO4(ж) + 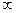 H2O = H2SO4(р) ΔН0298 = -22,77 ккал
H2O = H2SO4(р) ΔН0298 = -22,77 ккал
H2SO4(ж) + 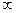 H2O = 2H+(р-р) + SO4 2-(р-р)
H2O = 2H+(р-р) + SO4 2-(р-р)
(-ΔН раств), ккал\моль





 -22,77
-22,77

 20
20
 | |||||
 | |||||
 |
 10
10
 ·
·
 |







 0
0
1 10 100 103 104 105 106 n, моль H2O
|
Дата добавления: 2014-01-06; Просмотров: 298; Нарушение авторских прав?; Мы поможем в написании вашей работы!