
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа химического равновесия
Окислительно-восстановительные процессы и реакции
Ничто не происходит без достаточного основания
М.В.Ломоносов
Термодинамическое условие равновесия - ∆G=0
Кинетическое условие равновесия – равенство скоростей прямой и обратной реакции и постоянство концентраций реагирующих веществ.
При постоянных P,Т для гомогенной реакции:

 аА + bВ + … dD + eE +…
аА + bВ + … dD + eE +…
константа равновесия рассчитывается:
- если вещества А, В, Е и D находятся в растворенном состоянии по формуле:
 ;
;
- если вещества А, В, Е и D находятся в газообразном состоянии по формуле:
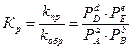 ,
,
где сi, pi – равновесные концентрации и парциальные давления
Парциальное давление i-того компонента газовой смеси – это такое давление, которое имел бы этот компонент при данной температуре, если бы он один занимал тот же объем, какой имеет газовая смесь.
Концентрация и давление компонента, входящие в уравнения для константы равновесия выражают в относительных единицах, а именно как отношение к стандартным единицам с= 1 m (моляльность) и р=1 атм, поэтому величины, входящие в выражение константы равновесия получаются безразмерными.
Для конденсированных фаз (твердое, жидкое состояние) стандартная концентрация равна реальной концентрации данного вещества и относительная безразмерная концентрация равна 1, поэтому концентрации конденсированных фаз в уравнение константы равновесия не входят, например, для реакции:
СО2(г) + С(гр) = 2СО(г) 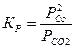
|
|
Дата добавления: 2014-01-06; Просмотров: 303; Нарушение авторских прав?; Мы поможем в написании вашей работы!