
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентраций растворов
Идеальные растворы
Смеси, процесс образования которых не сопровождается тепловыми и объемными эффектами, т.е. ∆Нпр .=0 и ∆V =0, называются идеальными.
В реальных растворах присутствуют тепловые и объемные эффекты, например, при смешивании 1л Н2О и 1 л спирта объем раствора равен 1,93 л, а не 2 л из-за образования водородных связей между молекулами воды и спирта.
Растворимость
| самопроизвольное растворение | ∆G <0 | ненасыщенный раствор |
| раствор, находящийся в равновесии с растворяющимся веществом | ∆G =0 | насыщенный раствор |
| система, находящаяся в кажущемся равновесии | ∆G >0 | пересыщенный раствор |
Растворимость данного вещества равна его концентрации в насыщенном растворе.
Абсолютно нерастворимых веществ нет, даже золото и серебро растворимы в воде (их растворимость очень низка).
- Массовая доля – отношение массы растворенного вещества к массе раствора (в процентах – процентная концентрация); доли, % масс.; или: процентная концентрация – содержание растворенного вещества в г в 100 г раствора.
- Молярная концентрация – отношение количества вещества (числа молей) к объему раствора; моль\л; или: содержание молей растворенного вещества в 1 л раствора.
- Нормальная, или эквивалентная, концентрация – отношение количества эквивалента (числа моль эквивалентов) вещества к объему раствора; моль-экв\л; или: содержание моль эквивалентов растворенного вещества в 1 л раствора.
- Моляльная концентрация – число моль растворенного вещества, приходящегося на 1 кг растворителя; моль\кг.
- Титр – число граммов растворенного вещества в 1 мл раствора; г\мл.
Разбавленные растворы неэлектролитов.
Разбавленные растворы приближаются к идеальным, свойства таких растворов описываются более простыми уравнениями.
При рассмотрении данного раздела примем, что при изменении температуры из раствора выделяется (испаряется или кристаллизуется) только растворитель и что растворенное вещество не является электролитом.
Давление пара над растворами
Над жидкостью в результате процесса испарения (эндотермический процесс) образуется пар, который одновременно конденсируется (экзотермический процесс). Равновесное состояние системы жидкость - пар при данной температуре характеризуется давлением насыщенного пара.
Если в растворителе растворено нелетучее вещество, то концентрация растворителя в растворе меньше, чем в чистом растворителе и давление пара над растворм р1 меньше, чем над чистым растворителем р10.
Чем больше растворенного вещества в растворе, чем сильнее снижается давление пара растворителя над раствором, т.е. давление насыщенного пара растворителя над раствором р1 пропорционально мольной доле растворителя х 1:
р1= К∙ х1
Физический смысл коэффициента К состоит в том, что в отсутствии растворенного вещества К = р10. Поэтому:
р1= р10∙ х1 - давление насыщенного пара растворителя над раствором равно произведению его давления над чистым растворителем на мольную долю растворителя ( первый закон Рауля, 1887 г.) или, если вместо мольной лоди растворителя х1 подставить (1 - х2 ), где х2 - мольная доля растворенного вещества, то после преобразований можно получить:
(р10 - р1)/ р10= х2 - относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества (вторая формулировка закона Рауля).
Температуры кипения и отвердевания растворов
В прямой зависимости от давления насыщенного пара над раствором нелетучего вещества находится температура кипения раствора.
Температурой кипения жидкости является температура, при которой давление ее насыщенного пара равно внешнему давлению (так, при 101 кПа температура кипения воды равна 100 0С, бензола 80 0С).
Из-за понижения давления насыщенного пара растворителя при наличии в растворе нелетучего вещества, температура кипения раствора выше температуры кипения растворителя.
С понижением давления пара над раствором связана более низкая температура отвердевания раствора, чем у чистого растворителя (температура отвердевания - это температура, при которой давление пара над жидкостью становится равным давлению пара над твердой фазой). Температура отвердевания раствора отвечает выделению из него первого кристалла твердой фазы - кристаллического растворителя.
Так как для разбавленных растворов понижение давления пара растворителя пропорционально концентрации, то и повышение температуры кипения и понижение температуры отвердевания разбавленных растворов пропорциональны концентрации растворенного вещества.
∆Ткип = Еm;
∆Тотв = Кm
m - моляльность раствора
Е - эбулиоскопическая постоянная;
К - криоскопическая постоянная
Постоянные Е, К не зависят от природы растворенного вещества, а характеризуют лишь растворитель.
Поскольку ∆Ткип, ∆Тотв изменяются пропорционально числу молей растворенного вещества, а каждый моль содержит одинаковое число молекул (число Авагадро), то повышение температуры кипения и понижение температуры отвердевания раствора пропорциональны числу частиц растворенного вещества и не завися от его природы (второй закон Рауля).
Осмотическое давление.
Процесс самопроизвольного перехода растворителя в раствор через полупроницаемую перегородку называют осмосом.

Гидростатическое избыточное давление, создаваемое раствором, препятствующее диффузии растворителя через полупроницаемую перегородку в раствор, называется осмотическим давлением.
рост =сRT или ростV =nRT
Закон Вант-Гоффа: осмотическое давление раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объем, который занимает раствор.
Определение молекулярной массы растворенного вещества
Пользуясь преобразованными выражениями законов Рауля и Вант-Гоффа можно определить молекулярную массу растворенного вещества:
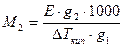 и
и 
 , где
, где
М2 - молярная масса;
Е, К - эбулиоскопическая и криоскопическая постоянные
g2 - масса растворенного вещества
g1 - масса растворителя

|
|
Дата добавления: 2014-01-06; Просмотров: 295; Нарушение авторских прав?; Мы поможем в написании вашей работы!