
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства и закономерности поведения дисперсных систем
Различные формы состояния вещества.
Задачи
- Напишите уравнения гидролиза солей K2CO3, FeCl3, Pb(CH3COO)2, NaCl в молекулярной, полной и сокращенной ионных формах; укажите рН растворов.
- Рассчитайте константы гидролиза солей: КNO2, NH4Cl, FeCO3, если константы диссоциации составляют соответственно для:
HNO2 – 4,6∙10-4; NH4OH – 1,8∙10-5; Fe(OH)2 – 1,3∙10-4; Н2СО3 II –
4,8∙10-11.
Лекция 13
Все вышерассмотренные закономерности в изменении свойств элементов, протекания химических реакций (термодинамика, кинетика химических процессов) рассматривались на основе атомно-молекулярной теории строения вещества.
Атомы – частицы, размером примерно от 0,05 до 0,24 нм, что зависит от атомной массы – наименьшая частица элемента (элемент характеризуется атомами одного вида), сохраняющая его свойства и состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов.
Молекула (новолат. molecula, уменьшительное от лат. moles — масса), наименьшая частица вещества, обладающая его химическими свойствами. Молекула состоит из атомов, точнее — из атомных ядер, окружающих их внутренних электронов и внешних валентных электронов, образующих химические связи. Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул данного вещества не зависят от способа его получения. В случае одноатомных молекул (например, инертных газов) понятия молекулы и атома совпадают.
Впервые понятие о молекуле было введено в химии в связи с необходимостью отличать молекулу как наименьшее количество вещества, вступающее в химические реакции, от атома как наименьшего количества данного элемента, входящего в состав молекулы. (Международный конгресс в Карлсруэ, 1860). Основные закономерности строения молекулы были установлены в результате исследования химических реакций, анализа и синтеза химических соединений, а также благодаря применению ряда физических методов.
Атомы объединяются в молекулы в большинстве случаев химическими связями. Как правило, такая связь создаётся одной, двумя или тремя парами электронов, которыми владеют сообща два атома. Молекула может содержать положительно и отрицательно заряженные атомы, т. е. ионы; в этом случае реализуются электростатические взаимодействия. Помимо указанных, в молекуле существуют и более слабые взаимодействия между атомами. Между валентно не связанными атомами действуют силы отталкивания.
В последние 20 лет (с 90-х годов ХХ века) благодаря развитию методов исследования (электронная микроскопия высокого разрешения, зондовая сканирующая микроскопия, высокоселективная масс-спектроскопия) в сочетании со специальными методами приготовления образцов позволило получать информацию о частицах, содержащих небольшое, менее сотни количество атомов, с размером.около 1 нм (10-9м). Наноразмерные объекты занимают промежуточное положение между объемными материалами и атомами (или молекулами). Подобные частицы обнаружили необычные, трудно предсказуемые химические свойства. Присутствие таких объектов в материалах придает материалам новые физические и химические свойства. Изучением свойств наноразмерных частиц занимается новая область химии- нанохимия.
Нанохимия - область химии, исследующая получение, свойства и рекционную способность частиц и сформированных из них ансаблей, которые по крайней мере в одном измерении имеют размер менее 10 нм. Частицы с размерами, близкими к 100 нм, правильнее рассматривать как ультрадисперсные, а получаемые на их основе материалы - как микроскопические.
Мир макровеличин представляет собой объекты, состоящие из колоссального количества образующих их атомов и молекул. Эти объекты по структуре могут быть как внутренне однородными, так и неоднородными. В самых совершенных внешне однородных материалах (например, сплавы металлов) имеются неоднородные области, обладающие своими особенностями и отличиями, появление которых определяется технологией производства, условиями кристаллизации и т.д. (пустоты, искажение формы кристалла). Так как объекты макромира массивны и объемны, все неоднородности сглаживаются, а характеристики и параметры описывают его свойства в целом (температуры кипения и плавления, электропроводность). Для макромира это естественно и закономерно. Законы классической физики (закон Ома, закон Ньютона), действующие в этом мире, опираются на неопровержимые экспериментальные данные и абсолютно справедливы для тех условий, которые они описывают.
Точно так же справедливы законы квантовой механики, описывающие мир атомов, молекул и элементарных частиц. В этом мире все объекты одного типа (например, атомы одного элемента, электроны, позитроны или мюоны) абсолютно одинаковы и статистически абсолютно неразличимы. На этом положении построены все наши представления о мире атомов и молекул.
Иная ситуация складывается в наномире. Здесь не действуют законы ни классической физики, ни квантовой механики. Наносистемы как составные части наномира представляют собой взвесь наночастиц размером не более 100 нм в некоторой среде (водной, газообразной, твердой).
На рисунке 1 приведен масштаб макро-, микро- и нанообъектов.
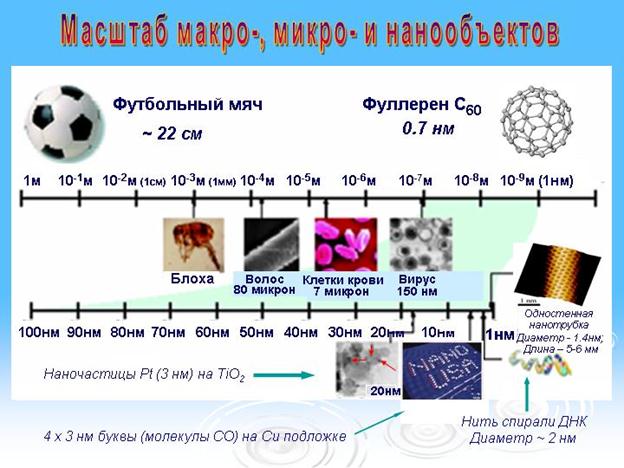
Рис.1 Масштаб макро-, микро- и нанообъектов
В нанохимии, находящейся в стадии быстрого развития, возникают вопросы, связанные с понятиями и терминами, такими как: " кластер", "наночастица", "квантовая точка ". Термин " кластер " используется для частиц, включающих небольшое количество атомов, термин " наночастица " - для более крупных агрегатов атомов, обычно, при описании свойств металлов и углерода. " Квантовой точкой ", как правило, называют частицы полупроводников и островков, где квантовые ограничения носителей зарядов влияют на их свойства (наночастицы, способные удерживать электроны и управлять их движением за счет ярко выраженной разности энергии своих составных частей). Если в наночастице наблюдается ярко выраженное упорядоченное расположение атомов (или ионов), то такие наночастицы называют нанокристаллитами.

Рис. 2. Кластеры воды (http://www.wateroflive.ru)
В табл.1 приведена классификация наночастиц в представлении разных авторов. Она связана с диаметром частицы в нанометрах и с числом атомов в частице (N). Классификация также учитывает отношение числа поверхностных атомов к числу объемных.
Таблица 1
Классификация частиц по размерам в представлении разных авторов
| У. Крейбиг | |||||||||||||||||
| Область I Молекулярные кластеры | Область II кластеры твердого тела | Область III микрокристаллы | Область IV Частицы компактного вещества | ||||||||||||||
| N ≤10 | 102 ≤ N ≤103 | 103 ≤N ≤104 | N ≥ 105 | ||||||||||||||
| Поверхность и объем неразличимы | соотношение поверхность/объем =1 | соотношение поверхность/объем <1 | соотношение поверхность/объем <<1 | ||||||||||||||
| К. Клабунде | |||||||||||||||||
| Химия | Наночастицы | Физика твердого тела | |||||||||||||||
| Атом | N=10 | N=102 | N=103 | N=104 | N=106 | Компактное вещество | |||||||||||
| Размер, нм 1 2 3 5 7 10 100 | |||||||||||||||||
| Н. Такео | |||||||||||||||||
| Сверхмалые кластеры | Малые кластеры | Большие кластеры | |||||||||||||||
| 2 < N ≤ 20 | 20 < N ≤ 500 | 500 < N ≤ 107 | |||||||||||||||
| 2R ≤ 1,1 нм | 1,1 нм ≤ 2R ≤ 3,3 нм | 3,3 нм ≤ 2R ≤ 100 нм | |||||||||||||||
| Поверхностный и внутренний объемы неразделимы | 0,9 ≥ Ns/Ny ≥ 0,5 | 0,5 ≥ Ns/Ny | |||||||||||||||
| Г.Б. Сергеев, В.Е. Боченков | |||||||||||||||||
| Химия атомов | Нанохимия | Химия твердого тела | |||||||||||||||
| Число атомов в частице | |||||||||||||||||
| Единичные атомы | 102 | 103 | 104 | 105 | Компактное вещество | ||||||||||||
| Диаметр, нм | 1 2 3 5 7 10 | >100 | |||||||||||||||
Таким образом, наночастицы можно понимать как системы, состоящие из еще более мелких единиц – кластеров – минимальных строительных “кирпичиков” вещества.
Размер кластера согласно большинству авторов не превышает 10 нм. На уровне кластеров активно проявляются всевозможные эффекты, которые называют размерными, так как они зависят именно от размера частиц. Как правило, размерные эффекты проявляются, когда размер частиц не превышает 100 нм, и наиболее отчетливо проявляются, когда их размер становится менее 10 нм.
Согласно номенклатуре ИЮПАК (IUPAC – Международный союз теоретической и прикладной химии), наночастицы – это частицы, размеры которых не превышают 100 нм и состоят из 106 или меньшего количества атомов.
Наночастицу принято рассматривать как составную часть объемного материала, которая демонстрирует самые разнообразные структурные элементы:
одномерные (тонкие пленки, в которых нанометровый размер имеет только толщина);
двумерные (структуры, полученные на тонких пленках методами осаждения или сорбции на них наночастиц металлов);
трехмерные (пористые материалы, пористые стекла) и всевозможные их комбинации.
По размерному признаку нанообъекты делят на три типа.
1) Нанообъектыквазинульмерные(0D) – это наночастицы (кластеры, коллоиды, нанокристаллы и фуллерены), содержащие от нескольких десятков до нескольких тысяч атомов, сгруппированных в связки или ансамбли (рис. 3,4). В этом случае все три измерения (длина, ширина, высота) нанометровые.

Рис. 4. Нанокристаллы селенида кадмия
Коллоиды - агрегаты, состоящие из обычных молекул – мицеллы (макромолекулы) от 100 до 1 нм
Мицелла (новолат. micella, уменьшительное от лат. mica — крошка, крупинка), отдельная частица дисперсной фазы золя, т. е. высокодисперсной коллоидной системы с жидкой дисперсионной средой. Мицелла состоит из ядра кристаллической или аморфной структуры и поверхностного слоя, включающего сольватно связанные молекулы окружающей жидкости. Поверхностный слой мицеллы лиофобного золя образован адсорбированными молекулами или ионами стабилизирующего вещества. В случае лиофобных гидрозолей, стабилизованных электролитами, ядро мицеллы окружено двумя слоями противоположно заряженных ионов, т. н. двойным электрическим слоем. Число положительных и отрицательных зарядов в нём одинаково, и поэтому мицелла в целом электронейтральна.
Непосредственно у поверхности ядра расположены ионы адсорбционного слоя. В него входят все ионы одного знака и часть ионов другого знака (противоионы). Остальные противоионы образуют диффузный слой; он окружает мицеллу в виде ионного "облака", плотность которого падает по мере удаления от ядра. Диффузный слой препятствует сближению и агрегированию (сцеплению) частиц в процессе броуновского движения.
В лиофильных золях, коллоидных дисперсиях типа гидрозолей мыл, например олеата натрия или лаурилсульфата калия, мицелла представляет собой ассоциат (объединение) молекул. В каждой такой молекуле длинный углеводородный (гидрофобный) радикал связан с полярной (гидрофильной) группой. При образовании мицеллы несколько десятков или сотен молекул объединяются так, что гидрофобные радикалы образуют ядро (внутреннюю область), а гидрофильные группы — поверхностный слой мицеллы. Если дисперсионной средой является органическая жидкость, ориентация молекул в мицеллы может быть обратной: в ядре сосредоточатся полярные группы, тогда как гидрофобные радикалы будут обращены во внешнюю фазу. Изобразив молекулу мицеллообразующего вещества в виде волнистой линии (гидрофобный радикал) с кружочком на конце (гидрофильная группа), можно представить простейшие структурные типы мицеллы. схемами:
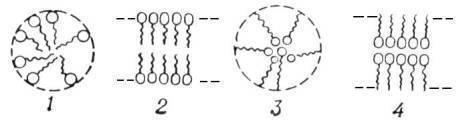
Рис.4 Мицеллярные структуры 1 и 2 относятся к гидрофильным золям, а 3 и 4 — к органофильным.
Сферические мицеллы (1 и 3) при разбавлении системы ниже критической концентрации мицеллообразования обратимо распадаются на отдельные молекулы или димеры. При более высоких концентрациях сферические мицеллы превращаются в пластинчатые (2 и 4). Последние, взаимодействуя между собой, способны создавать в объёме системы структурную сетку геля Наличием мицелл объясняется моющее действие водных растворов (точнее, коллоидных дисперсий) мыл, а также некоторые явления в биологических системах и при технологических процессах.
2) Квазиодномерные нанообъекты (1D): углеродные нанотрубки и нановолокна, наностержни, нанопроволоки – т.е. цилиндрические объекты с одним измерением в несколько микрон и двумя нанометровыми (рис. 5 и 6). В данном случае один характерный размер объекта (длина), по крайней мере, на порядок превышает два другие; физики такие объекты называют «квантовые провода».

Рис. 5. Нанопроволока меди (http://www.nanorf.ru/appeal.asp)

Рис. 6. Наностержни гидроксида никеля, выращенные внутри углеродных нанотрубок (http://hidroxidy.narod.ru/prim.html)
3) Двумерные нанообъекты (2D) – покрытия или пленки толщиной в несколько нанометров на поверхности блочного материала. В этом случае только одно измерение (ширина) нанометровое, два других (длина и высота) являются макроскопическими.
Итак, наночастица – это квазинульмерный нанообъект, у которого все характерные линейные размеры имеют один порядок величины. Как правило, наночастицы имеют сферическую форму.
В природе и технологии нанообъекты, как правило, это многочастичные системы, которые в современной науке обозначаются различными терминами: "нанокристалл", "нанофаза". "наносистема", "наноструктура", "нанокомпозиты". Основу всех названных объектов составляют индивидуальные, изолированные наночастицы. Например, наноструктуру можно определить как совокупность наночастиц определенного размера с наличием функциональных связей. Нанокомпозиты - это объекты, где наночастицы упакованы вместе в макроскопический образец, в котором межчастичные взаимодействия становятся сильными и маскируют свойства изолированных частиц.
Для каждого вида взаимодействий важно знать, как изменяются свойства материала в связи с его размерами.
К размерным эффектам относятся: химическая активность, потенциал ионизации, энергия связи между атомами в частице и между частицами, кристаллографическая структура. Температуру плавления и оптические свойства также можно рассматривать как функцию размера частицы и ее геометрии. Влияние размерных эффектов наноматериалов проявляется в изменении оптических, каталитических, механических, магнитных, термических и электрических свойств.
Необходимо отметить, что с уменьшением размера наночастицы понятие фазы выражено менее четко: границы между гомогенной и гетерогенной фазами, между аморфным и кристаллическим состоянием вещества провести трудно. В настоящее время обычные представления химии, включающие понятия состав-свойства, структура-функция, дополняются понятиями размера и самоорганизации, которые ведут к обнаружению новых фактов и закономерностей. Тем не менее все успехи в развитии нанохимии пока не позволяют ответить в общем на вопрос о связи размера частиц, например, металла с его свойствами.
Наночастицы металлов менее 10 нм являются системами, обладающими избыточной энергией и высокой химической активностью. Частицы размером порядка 1 нм практически без энергии активации вступают в процессы агрегации, ведущие к образованию наночастиц металлов, и в реакции с другими химическим соединениями, в результате которых получаются вещества с новыми свойствами. Запасенная энергия таких объектов определяется в первую очередь нескомпенсированностью связей поверхностных и приповерхностных атомов. Это может приводить к возникновению необычных поверхностных явлений и реакций.
Специфические размерные эффекты наиболее сильно проявляются в малых частицах и особенно характерны для нанохимии, где преобладают нерегулярные зависимости свойств от размера.
Зависимость химической активности от размера реагирующих частиц объясняется тем, что свойства индивидуальных атомов элементов и формируемых из атомов кластеров и наночастиц отличаются от свойств аналогичных макрочастиц. Так кинетика реакций в маломасштабных системах с ограниченной геометрией отличается от классической, которая не учитывает флуктуаций концентрации реагирующих веществ.
В наночастицах значительное число атомов находится на поверхности и их доля растет с уменьшением размера частиц. Соответственно увеличивается и вклад поверхностных атомов в энергию системы. Отсюда возникает ряд термодинамических следствий, например зависимость от размера температуры плавления наночастиц. С размером, влияющим на реакционную способность, связаны и такие свойства частиц, как изменение температуры полиморфных превращений, увеличение растворимости, сдвиг химического равновесия. Размер частицы можно рассматривать как эквивалент температуры. Это означает, что для наномасштабных частиц возможны реакции, в которые не вступают вещества, находящиеся в компактном состоянии.
Но надо иметь в виду, что в настоящее время размер получаемых наночастиц металлов трудно регулировать. Часто он определяется способом синтеза и плохо воспроизводим.
Тем не менее, уже имеются данные о том, что изменение химических и физических свойств наночастиц металлов, образуемых из атомов, свидетельствуют об их определенной периодичности в зависимости от числа атомов в частице, формы и способа организации. Имеются сведения о создании электронной и геометрической таблиц по аналогии с периодической таблицей Д.И. Менделеева. На примере атомов натрия показано, что частицы Na3, Na9 и Na19 являются одновалентными, а галогеноподобные кластеры Na7 и Na17 обладают повышенной активностью. Наименьшую активность имеют частицы с закрытыми электронными оболочками - Na2, Na8, Na18, Na20.
В настоящее время интенсивно развиваются не только исследования, но и нанотехнология, которая имеет дело как с отдельными нанообъектами, так и с материалами на их основе, а также процессами на наноуровне. Наноматериалы – материалы, основные физические характеристики которых определяются свойствами содержащихся в них нанообъектов; кристаллические или аморфные системы с размером частиц или кристаллитов менее 100 нм. Изучая такие структуры, исследователи накапливают знания и опыт для целенаправленного усовершенствования свойств известных материалов и производства новых материалов с заданными свойствами.
Примером проявления размерного эффекта являются свойства наночастиц графита - фуллеренов, нанотрубок и графена. (см.рис.7).
Углеродные нанотрубки – свернутые в цилиндр листы, состоящие из атомов углерода. Крошечные трубочки (в 50.000 раз тоньше человеческого волоса) имеют исключительные электронные и физические свойства. Их невероятный предел прочности на разрыв позволяет уже сейчас использовать нанотрубки для создания композитных полимеров и составляющих бетона. Но многие исследователи ищут способы использования их в электронных цепях и в телевизионных экранах.

Рис.7 Аллотропные модификации углерода
Имеются примеры изменения свойств материалов, полученных с применением других наночастиц, напримерSiO2 - НаноБетон.Оксид кремния (SiO2) – это часть стандартной бетонной смеси. Исследования наноструктуры материала показали, что использование наночастиц оксида кремния приводит к существенным изменениям в упаковке вещества – значительному уплотнению бетона и соответственному улучшению его механических свойств (повышению прочности на сжатие в 3–6 раз). Кроме того, модификация материала наночастицами оксида кремния стабилизирует важнейшие валентные взаимодействия Ca – Si – H, ответственные за связность бетона, уменьшая вымывание кальция и увеличивая его влагоустойчивость.
В настоящее время основными областями применения наночастиц в технике, определяемыми их уникальными свойствами, отличными от свойств веществ в обычной (макродисперсной) форме, становятся создание высокопрочных, в том числе композитных, конструкционных материалов, микроэлектроника и оптика (микросхемы, компьютеры, оптические затворы), энергетика (аккумуляторы, топливные элементы, высокотемпературная сверхпроводимость), химическая технология (катализ), охрана окружающей среды (наночипы и наносенсоры).
В пищевой промышленности наноматериалы находят применение в фильтрах для очистки воды, при получении более легких, прочных, более термически устойчивых и обладающих антимикробным действием упаковочных материалов, при обогащении пищевых продуктов микронутриентами.
Контрольные вопросы
1. Что такое кластеры и наночастицы? Чем они отличаются от отдельных молекул и атомов?
2. Что такое коллоидное состояние вещества?,
3. Назовите виды структурных элементов материалов на основе наночастиц.
4. Перечислите размерные типы нанообъектов, приведите примеры.
5. Назовите физико-химические свойства, которые меняются при изменении размеров наночастиц. Чем обусловлено это изменение?
Лекция 14
|
|
Дата добавления: 2014-01-06; Просмотров: 1161; Нарушение авторских прав?; Мы поможем в написании вашей работы!