
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обратимость реакций и химическое равновесие
|
|
|
|
Всякая химическая реакция связана с образованием конечных продуктов из исходных веществ, т. е. внешне имеет одностороннюю направленность. Однако в действительности одновременно с прямой реакцией всегда идет и обратная реакция, в ходе которой из конечных продуктов образуются исходные вещества. Видимость односторонней направленности создается тем, что скорость прямой реакции больше скорости обратной реакции, вследствие чего по мере протекания процесса количество исходных веществ уменьшается, а конечных продуктов увеличивается. Это изменение соотношения между компонентами реакции определяется результативной скоростью реакции, представляющей собой разность скоростей прямой и обратной реакций.
Если скорость обратной реакции при данных условиях несоизмеримо мала по сравнению со скоростью прямой реакции, то процесс.идет практически до конца, т. е. до практически полного исчезновения исходных веществ. Такие реакции носят название химически необратимых и записываются в общем виде следующим образом
aA+bB+...→ cC+dD+...
Если же скорость обратной реакции при данных условиях соизмерима со скоростью прямой реакции, то полное превращение исходных веществ в конечные продукты невозможно. Такие реакции называются химически обратимыми и записываются в общем виде следующим образом
aA+bB+...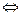 cC+dD+...
cC+dD+...
Следует иметь в виду, что в принципе, как это следует из сказанного, все реакции химически обратимы.
В ходе обратимой реакции, описываемой последним уравнением, концентрация исходных веществ уменьшается, а вместе с ней уменьшается и скорость прямой реакции
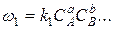 .
.
Одновременно возрастает концентрация конечных продуктов и увеличивается скорость обратной реакции
|
|
|
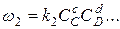 .
.
Это влечет за собой уменьшение результирующей скорости
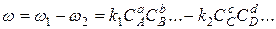 ,
,
которая, в конце концов становится равной нулю. При этом видимое течение реакции прекращается, так как количество исходных веществ, расходуемых на образование конечных продуктов, становится равным количеству их, образующихся из конечных продуктов. Наступает состояние так называемого химического равновесия, которое является равновесием динамическим: при нем прекращается лишь видимое изменение состояния системы, но продолжают протекать с одинаковыми скоростями противоположно направленные реакции. Поэтому условие химического равновесия может быть записано в виде равенства скоростей прямой и обратной реакции
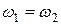
или
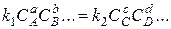 ,
,
где буквами с обозначены равновесные концентрация компонентов реакции.
Отсюда имеем
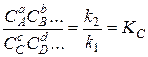 . (14.14)
. (14.14)
Поскольку константы скорости k1 и k2 не зависят от изменяющихся в ходе реакций концентраций, от них не зависит и величина КС. Как будет показано ниже, численное значение этой величины для каждой реакции однозначно определяется давлением и температурой равновесной смеси исходных веществ с продуктами этой реакции. Характеризуя собой состав этой равновесной смеси, величина КС является весьма важной характеристикой реакции и называется константой равновесия.
Если в химически равновесной системе, занимающей объем V, число киломолей какого-либо из газообразных реагентов равно n, то согласно определению равновесная концентрация этого реагента выражается следующим образом
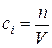 , откуда
, откуда 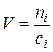 .
.
Подставляя это выражение в уравнение состояния рассматриваемого реагента
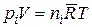 ,
,
в котором  – универсальная газовая постоянная, получаем, что концентрация всякого газообразного реагента равновесной химической системы пропорциональна его парциальному давлению в этой равновесной системе
– универсальная газовая постоянная, получаем, что концентрация всякого газообразного реагента равновесной химической системы пропорциональна его парциальному давлению в этой равновесной системе
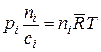 или
или 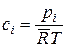 . (14.15)
. (14.15)
Из этого следует, что константа равновесия может быть выражена не только через равновесные концентрации, но и через равновесные парциальные давления компонентов. Подставляя в формулу (14.14) вместо концентраций парциальные давления, получаем
|
|
|
.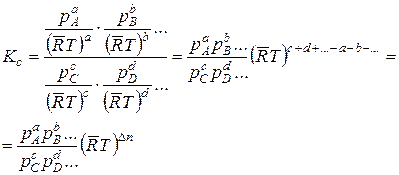
Здесь Δn = с+d+…-a-b-… представляет собой увеличение числа киломолей газообразных компонентов в результате реакции. Выражение

в такой же мере характеризует реакцию и равновесный состав системы, как и КС. Поэтому оно тоже называется константой равновесия, но в отличие от КС обозначается буквой КР. Из полученных соотношений видно, что связь между КС и КР выражается уравнением
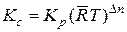 . (14.16)
. (14.16)
Если известно численное значение константы равновесия КС или КР и исходные концентрации реагентов, то в каждом конкретном случае можно не только установить степень полноты протекания реакции, но и вычислить равновесный состав компонентов реакции. Естественно, что исходные соотношения при этом имеют индивидуальную форму, зависящую от характера рассматриваемой реакции.
Следует заметить, что в любой химической системе взаимодействие между компонентами не ограничивается какой-либо одной реакцией. В ней одновременно протекает множество других реакций, наличие которых неизбежно вследствие тесного контакта между компонентами. Например, если в начальном состоянии система состоит из метана СН4 и кислорода О2, то наряду с основной реакцией окисления метана
СН4+2О2  СО2+2Н2О
СО2+2Н2О
в ней возможны и действительно протекают реакции
СН4 ↔ С+2Н2; CO2 
 C+O2; 2СО2 ↔2СО+О2;
C+O2; 2СО2 ↔2СО+О2;
2Н2О ↔ 2Н2+О2; CO+H2O ↔ CO2+H2
и многие другие реакции разложения, восстановления и соединения между входящими в состав системы компонентами.
Естественно, что при равновесном состоянии системы в целом имеет место и равновесие каждой из этих реакций в отдельности. Это означает, что константы равновесия всех этих реакций при данной температуре имеют такие численные значения, которые дают один и тот же равновесный состав смеси. Поэтому и можно, зная константу равновесия лишь одной из всех возможных для данной системы реакций, определить равновесный состав этой системы. С другой стороны, это означает, что все константы равновесия упомянутых реакций взаимосвязаны и поэтому по известным значениям констант равновесия для одних реакций можно определить неизвестные значения констант равновесия других, не поддающихся прямому исследованию, реакций.
|
|
|
Например, предположим, требуется определить константу равновесия КР реакции
2СО+2Н2 ↔ СН4+СО2,
если известны константы равновесия реакций
2СО ↔ С+СО2; С+2Н2 ↔ СН4.
Формулы для этих известных констант равновесия имеют вид
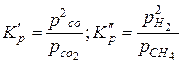 .
.
Перемножая левые и правые части этих равенств, получаем
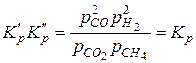 .
.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1009; Нарушение авторских прав?; Мы поможем в написании вашей работы!