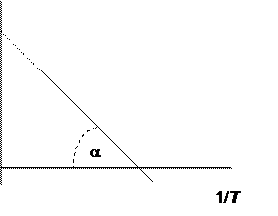КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы вычисления констант равновесия
|
|
|
|
а) Интегрируя после разделения переменных уравнение изобары (4.6) в предположении, что тепловой эффект реакции мало зависит от температуры
| 2 DHr Т2 dT ò d ln Kp = ¾¾ ò ¾¾ 1 R Т1 T 2 |
получаем
| Kp 2 DHr 1 1 ln Kp 2 - ln Kp 1 = ln ¾¾ = ¾¾ (¾ - ¾) Kp 1 R Т1T2 |
или
| Kp 2 DHr Т2 - Т1 ln ¾¾ = ¾¾ (¾¾¾¾), Kp 1 R Т1T2 |
где Kp 1 и Kp 2 - константы равновесия реакции при температурах Т1 и T2 соответственно; DHr - изобарный тепловой эффект реакции в интервале температуры Т1 ¸ T2.
С помощью этого уравнения по DHr и одной из Кр (как правило, по стандартному тепловому эффекту DHоr 298, вычисленному по справочным данным, и Кр 1 при температуре Т1 = 298 К) можно вычислить другую константу равновесия Кр 2 при любой другой температуре Т2. С другой стороны, с помощью двух констант равновесия Кр 1 и Кр 2 при двух температурах Т1 и Т2 можно рассчитать средний тепловой эффект реакции. Необходимо помнить, что этот способ вычисления Кр применим в не очень большом интервале температуры, когда зависимостью теплового эффекта от температуры можно пренебречь.
Для изохорных условий, например, для реакций, идущих в растворах, можно получить аналогичное выражение, в которое входят константы равновесия Кс и изохорный тепловой эффект DUоr:
| Kc 2 DUr Т2 - Т1 ln ¾¾ = ¾¾ (¾¾¾¾), Kc 1 R Т1T2 |
б) Как было показано ранее, при стандартных условиях имеет место равенство
DGor = - RT ln Kp.
В то же время изменение энергии Гиббса для реакции связано с её тепловым эффектом при постоянном давлении и изменением энтропии уравнением
DGor = DHor - TDSor.
Объединяя два этих выражения, получаем
- RT ln Kp = DHor - TDSor,
откуда следует, что
|
|
|
| DSor DHоr ln Kp = ¾¾ - ¾¾. R RТ |
Это выражение называется уравнением Вант-Гоффа. С его помощью по стандартным значениям DHor и DSor, (например, вычисленным по справочным значениям), можно рассчитать константу равновесия реакции для
Т = 298 К или для другой температуры, не очень намного отличающейся от 298 К.
С другой стороны, если известны значения Kp в некотором небольшом интервале температур, при посредстве уравнения Вант-Гоффа можно графическим способом определить величины DHor и DSor. График зависимости логарифма константы равновесия от 1/ T (рис. 4.1) представляет собой прямую линию с отрицательным углом наклона, причем тангенс угла наклона её к оси абсцисс равен - DHor / R, а точка пересечения графика с осью ординат дает DSor / R:
|
Рис. 4.1. Зависимость ln Kp - 1/ T для обратимой реакции
Следует помнить, что описанные способы вычисления константы равновесия химической реакции применимы лишь в достаточно узком интервале температуры. Когда разность Т2 - Т1 превышает несколько десятков градусов, требуется учитывать зависимость теплового эффекта реакции и теплоёмкости системы от температуры, что приводит к более сложным, но дающим более точные результаты уравнениям.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 564; Нарушение авторских прав?; Мы поможем в написании вашей работы!