
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кондуктометрическое титрование
|
|
|
|
Кондуктометрическое титрование - метод определения концентрации вещества, основанный на изменении удельной проводимости раствора при титровании. Изменение k связано с изменением концентраций ионов с различной подвижностью, происходящим при химических реакциях в титруемом растворе. Кондуктометрическое титрование можно проводить в окрашенных или мутных растворах. При нём не следует опасаться перетитровать раствор, более того, для нахождения точки эквивалентности это даже необходимо. Кривые титрования, представляющие собой зависимость k от объёма V титранта, добавляемого к исследуемому раствору, имеют излом в точке эквивалентности, причём форма кривых зависит от природы титранта и титруемого вещества.
При кондуктометрическом титровании наиболее широко используются реакции кислотно-основного взаимодействия. При этом возможны следующие типичные случаи.
1) Титрование раствора сильной кислоты раствором сильного основания. Кривая титрования имеет вид, показанный на рис. 9.4, а.
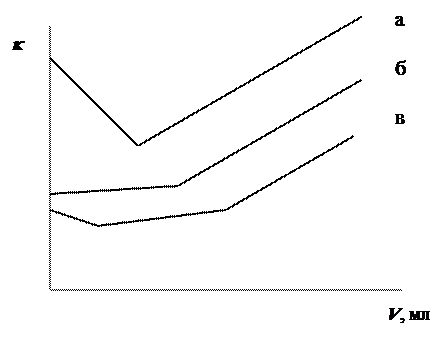 |
Рис. 9.4. Кривые кондуктометрического титрования
а – сильной кислоты сильным основанием,
б – слабой кислоты сильным основанием,
в – смеси сильной и слабой кислот сильным основанием
При постепенном добавлении к раствору кислоты (например, HCl) раствора основания (например, NaOH) концентрация ионов водорода уменьшается из-за связывания их гидроксид-ионами с образованием воды. Одновременно в растворе появляются ионы Na+, концентрация которых всё время увеличивается. Как было показано в п. 9.5, подвижность ионов Н+ намного больше подвижности ионов Na+. Поэтому проводимость раствора заметно уменьшается вплоть до точки эквивалентности, при которой достигается минимальное значение k. После связываания всех ионов Н+, когда в титруемом растворе появляются всё новые ионы ОН-, а вместе с ними и ионы Na+, проводимость начинает увеличиваться. Благодаря этому на кривой титрования в точке эквивалентности появляется излом. По его положению определяется точный объём титранта, пошедший на титрование.
|
|
|
Следует обратить внимание на то, что наклон второй ветви кривой титрования менее крут, чем первой, так как подвижность ионов ОН- меньше, чем подвижность ионов Н+. При титровании раствора основания раствором кислоты соотношение наклонов ветвей кривой будет обратным.
2) Титрование раствора слабой кислоты раствором сильного основания. Кривая титрования имеет вид, показанный на рис. 9.4, б. В этом случае при добавлении раствора сильного основания (например, NaOH) к раствору слабой кислоты (например, СН3СООН) концентрация ионов водорода вплоть до точки эквивалентности будет оставаться практически постоянной, так как титруются только свободные ионы Н+, возникающие при диссоциации слабой кислоты. Проводимость при этом будет несколько возрастать за счёт увеличения концентрации ионов Na+. После достижения точки эквивалентности зависимость проводимости от объёма титранта будет иметь такой же характер, как и предыдущем случае.
2) Титрование смеси растворов сильной и слабой кислот раствором сильного основания. Общий вид кривой титрования показан на рис. 9.3, в. Из-за присутствия в растворе сильной кислоты диссоциация слабой подавляется и вначале в реакцию нейтрализации будут вступать только ионы водорода, принадлежащие сильной кислоте. После того, как вся она будет оттитрована, начнётся диссоциация и последующая нейтрализация слабой кислоты и на кривой титрования появится первый излом, отвечающий объёму титранта, необходимому для полной нейтрализации сильной кислоты. Далее кривая титрования подчиняется тем же закономерностям, что и в случае 2.
|
|
|
На практике ветви кривых титрования могут получаться нелинейными, что связано с разбавлением раствора при добавлении титранта. Во избежание этого следует применять растворы титранта, значительно более концентрированные, чем титруемые растворы (обычно в 10 раз).
ГЛАВА 10
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 3569; Нарушение авторских прав?; Мы поможем в написании вашей работы!