
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. Второй закон термодинамики
|
|
|
|
Большинство процессов представляют собой два одновременно происходящих явления: передачу энергии и изменения в упорядоченности расположения частиц относительно друг друга. Мерой неупорядоченности среди частиц в системе служит функция состояния, которую называют энтропия S. В отличие от других функций состояния, для энтропии возможно определение не только изменения энтропии D S, но и абсолютного значения энтропии S.
Абсолютное значение энтропии можно вычислить по уравнению Больцмана (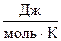 ):
):
S = R ×ln W,
где R - универсальная газовая постоянная; W - термодинамическая вероятность, которая показывает число микросостояний системы, при помощи которых может реализоваться определенное макросостояние.
При переходе вещества из твердого состояния в жидкое и далее в газообразное значительно увеличивается неупорядоченность частиц, поэтому
S газа >> S ж > S тв .
У веществ в аморфном состоянии энтропия будет больше, чем в кристаллическом, так как кристалл более упорядоченная структура. Например, для стекловидного и кристаллического SiO2 значения энтропии равны 46,9 и 42,7 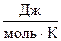 соответственно. При одинаковом агрегатном состоянии энтропия тем выше, чем больше атомов содержится в молекуле. Так, энтропии газообразных О, О2 и О3 равны соответственно 161, 205 и 239
соответственно. При одинаковом агрегатном состоянии энтропия тем выше, чем больше атомов содержится в молекуле. Так, энтропии газообразных О, О2 и О3 равны соответственно 161, 205 и 239 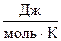 .
.
Энтропии многих веществ определены при стандартных условиях и приведены в справочной литературе. Энтропию при этих условиях называют стандартной энтропией и обозначают S 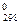 .
.
Расчет D S 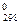 химической реакции осуществляют так же, как и изменение энтальпии реакции. Для реакции общего вида a A + b B = d D + f F
химической реакции осуществляют так же, как и изменение энтальпии реакции. Для реакции общего вида a A + b B = d D + f F
D S 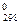 = d S
= d S 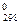 (D) + f S
(D) + f S 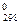 (F) – a S
(F) – a S 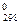 (A) – b S
(A) – b S 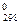 (B).
(B).
Об изменении энтропии в химической реакции можно судить по изменению объема системы в ходе реакции. Если объем системы увеличивается, то D S 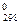 > 0, а если реакция протекает с уменьшением объема, то энтропия также уменьшается (D S
> 0, а если реакция протекает с уменьшением объема, то энтропия также уменьшается (D S 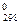 < 0).
< 0).
|
|
|
Для реакций между твердыми веществами изменения энтропии практически не происходит. То же относится и к процессам, в которых число моль газообразных веществ не изменяется.
Процессы, протекающие без подвода энергии от внешнего источника, называют самопроизвольными. Согласно второму закону термодинамики, в изолированной системе самопроизвольно идут только такие процессы, которые сопровождаются увеличением энтропии.
Таким образом, знак D S является критерием направления протекания процессов в изолированных системах:
1. Если D S > 0, то процесс протекает самопроизвольно в прямом направлении;
2. При D S < 0 направление самопроизвольного протекания процессов обратное;
3. В случае, когда D S = 0, изолированная система находится в состоянии равновесия.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 333; Нарушение авторских прав?; Мы поможем в написании вашей работы!