
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентная химическая связь
 |
1. Первую гипотезу о природе ковалентной химической связи выдвинул в 1919 году Льюис. Он предложил, что связь между атомами образуется в результате обобществления свободных электронов, находящихся на внешнем энергетическом уровне взаимодействующих атомов. Причем в зависимости от электроотрицательности общая электронная пара в той или иной степени принадлежит обоим взаимодействующим атомам. Если атомы не различаются друг от друга по электроотрицательности, то ковалентная связь неполярная, если различаются – то полярная. В случае полярной ковалентной связи происходит перераспределение общей электронной плотности между взаимодействующими атомами. Это явление получило название поляризации связи. Она сдвинута в сторону атома более электроотрицательного элемента. Мерой полярности связи служит дипольный момет. Диполем называют систему, состоящую из двух равных по величине, но разных по знаку зарядов, расположенных на некотором расстоянии друг от дуга. m = q*l. Единица измерения D-дебай. Дипольный момент – векторная величина равная сумме дипольных моментов каждой полярной химической связи.
На основе идеи Льюиса был разработан метод, в общем описывающий природу химических связей в простых и сложных веществах и получивший название метод валентных связей (Метод ВС). Данный метод позволяет различить три механизма образования ковалентной связи: обменный, донорно-акцепторный и дативный.
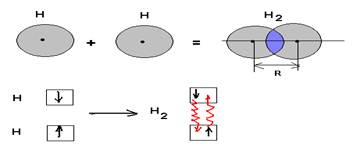
Обменный механизм образования ковалентной химической связи. Обменный механизм образования связи предусматривает обобществление электронов внешнего энергетического уровня взаимодействующих атомов с образование зоны повышенной электронной плотности, находящейся в межъядерном пространстве. Данное перекрывание не может быть бесконечным, так как после наступления критического уровня (R) начинают преобладать силы взаимного отталкивания ядер. Чтобы атомные орбитали перекрывались необходимо выполнение двух условий: первое - симметричное расположение относительно межъядерной оси; втрое – атомные орбитали должны быть близки по энергии. Образование любой химической связи обязательно должно вести к уменьшению внутренней энергии системы.
|
|
|
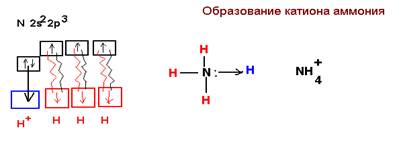
Донорно-акцепторный механизм образования связи Данный механизм связи также как и обменный предусматривает образование общей электронной пары в той или иной степени принадлежащей взаимодействующим атомам. Принципиальное отличие заключается в том, что один атом подает на образование связи не поделенную электронную пару и является донором, а другой свободную атомную орбиталь являясь акцептором. Примером может служить образование катиона аммония. В этом случае атом азота подает на образование связи 2s электроны и является донором, протон водорода выступает в качестве акцептора и подает на образование связи вакантную атомную орбиталь.
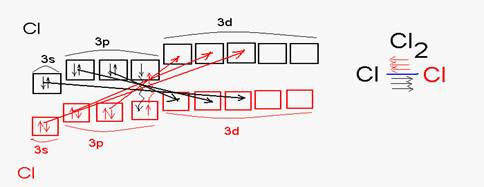
Дативный механизм образования химической связи Атомы, внешняя электронная оболочка которых состоит только из s и p- орбиталей могут быть или донорами или только акцепторами. Но если последний энергетический уровень включает в себя еще и d – орбиталь, то такой атом может проявлять одновременно и донорные и акцепторные свойства. Такой механизм связи называется дативным. Примером молекулы, образованной по дативному механизму, является молекула хлора. Атом хлора одновременно выступает и в роли донора (спаренные 3s и 3р –электроны) и акцептора (вакантные 3d-орбитали).
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1043; Нарушение авторских прав?; Мы поможем в написании вашей работы!