
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Планетарная модель атома
|
|
|
|
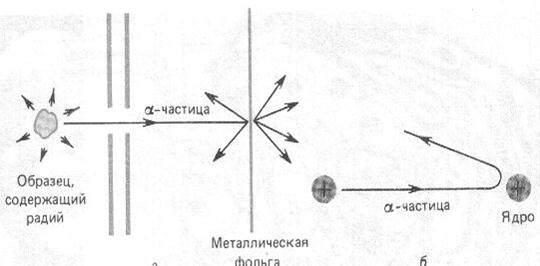
Резерфорд со своими учениками Г. Гейгером и Э. Марсденом начали исследования внутренней структуры атома с использованием α-частиц. Метод заключался в измерении зависимости числа частиц, рассеянных атомами золотой фольги (золотая фольга легко расплющивалась, что позволяло сделать ее очень тонкой ~ 0.4 мкм) под различными углами (рис. 12.6). В случае правильности модели Томсона, эти углы не должны быть большими, так как электроны, располагающиеся внутри атома много легче α-частиц. В экспериментах частицы попадали на экран, покрытый зернистым цинком. При ударе α-частиц об экран можно было наблюдать, рассматривая его в микроскоп, слабые вспышки (сцинтилляции). Микроскоп с экраном поворачивались вокруг вертикальной оси, что позволяло измерить их число под разными углами. В результате экспериментов, выполненных в конце 1910 года, оказалось, что большинство частиц рассеивались под малыми углами (1 - 2 градуса). Небольшая часть частиц рассеивалась на углы больше 2 градусов, а одна из 20000 частиц на углы 90 градусов и более. Это сильно противоречило модели Томсона, согласно которой атом представлялся рыхлым и не мог быть причиной отклонения частиц назад.
По мнению Резерфорда, такое могло наблюдаться только в случае если положительно заряженные α-частицы сталкиваются с массивным ядром, имеющим маленькие размеры по сравнению с размерами атома. Скорее всего, атом напоминает Солнечную систему, где вместо Солнца располагается ядро, а вместо планет – электроны. Размеры ядра по оценкам Резерфорда составляли около 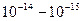 метра. Оказалось, что атом, в основном, пустой. Размеры ядра в 10000 – 100000 раз меньше размеров атома.
метра. Оказалось, что атом, в основном, пустой. Размеры ядра в 10000 – 100000 раз меньше размеров атома.
а)
б)
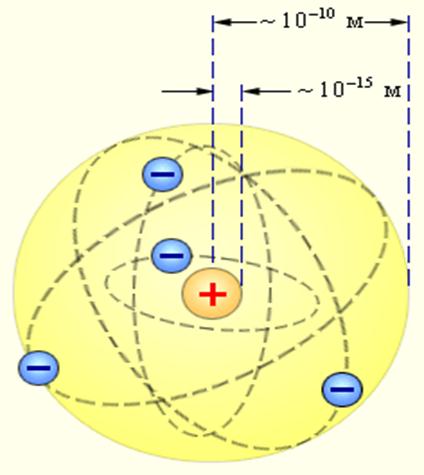
Рис. 12.6. Схема опытов Резерфорда (а), и модель атома Резерфорда (б).
|
|
|
Резерфорд предложил планетарную модель атома, положения которой заключались в следующем:
а) атом пустой и состоит из расположенных в его центре ядра и вращающихся вокруг него электронов;
б) размеры ядра в десятки тысяч раз меньше размеров атома, а его масса составляет более 99.9% массы атома;
в) атом нейтрален, заряд его ядра составляет +Zе, а вокруг него вращается Z электронов. Модель оказалась простой и изящной. Она объяснила рассеяние частиц на большие углы и назад.
Резерфорд стал первым человеком, который догадался о структуре строения атома[8].
Резерфорд экспериментально измерил заряд ядра. Для этого он, используя теорию движения частиц в центральном поле и методы математической статистики, вывел формулу[9], описывающую распределение частиц по углу рассеяния θ:
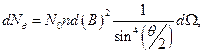 (12.3.1)
(12.3.1)
где 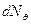 - число α- частиц, рассеянных на угол θ в пределах телесного угла
- число α- частиц, рассеянных на угол θ в пределах телесного угла 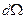 ;
; 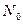 - число частиц, падающих на поверхность перпендикулярно направлению их движения; n- концентрация атомов вещества в единице объема; d- толщина фольги; m и v - масса и скорость частицы.
- число частиц, падающих на поверхность перпендикулярно направлению их движения; n- концентрация атомов вещества в единице объема; d- толщина фольги; m и v - масса и скорость частицы.
Чедвик, сотрудник Резерфорда, экспериментально исследовал величину:
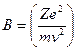 = const (12.3.2)
= const (12.3.2)
Анализируя результаты этих опытов, Ван-ден-Брук установил, что зарядовые числа Z у ядер атомов химических элементов совпадают с порядковыми номерами этих элементов в таблице Менделеева. Тем самым был установлен физический смысл порядкового номера химического элемента. Стало понятно, почему химические элементы таблицы Менделеева расположены в порядке возрастания заряда ядра на единицу. У атомов на единицу возрастает заряд ядра и становится больше на один электрон.
Планетарная модель атома Резерфорда явилась значительным шагом на пути к современным представлениям о строении атома. Однако она не была совершенной моделью. Любая частица движется по окружности с ускорением, а, следовательно, как установлено в классической электродинамике, излучает. Энергия излучения пропорциональна квадрату ускорения 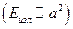 . Раз электрон излучает, он теряет энергию, а, следовательно, его радиус должен уменьшаться. Тогда он бы упал на протон, чего быть не должно. Кроме того, с уменьшением радиуса вращения электрона должна изменяться и частота его вращения вокруг атома. Поэтому спектр атома должен быть непрерывным, а не дискретным. Дискретные спектры атома водорода свидетельствовали о необходимости попробовать применить идею квантов, предложенную Планком и использованную Эйнштейном при объяснении фотоэффекта.
. Раз электрон излучает, он теряет энергию, а, следовательно, его радиус должен уменьшаться. Тогда он бы упал на протон, чего быть не должно. Кроме того, с уменьшением радиуса вращения электрона должна изменяться и частота его вращения вокруг атома. Поэтому спектр атома должен быть непрерывным, а не дискретным. Дискретные спектры атома водорода свидетельствовали о необходимости попробовать применить идею квантов, предложенную Планком и использованную Эйнштейном при объяснении фотоэффекта.
|
|
|
Полученное противоречие попытался решить Бор в предложенной им модели атома.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 474; Нарушение авторских прав?; Мы поможем в написании вашей работы!