
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Ван-дер-Ваальса
|
|
|
|
Экспериментальные исследования показали, что уравнение Бойля – Мариотта для реальных газов выполняется не совсем точно. Причиной этого является действие между молекулами, как сил притяжения, так и отталкивания. Кроме того, молекулы лишь в идеальном приближении можно считать упругими и имеющими пренебрежимо малые размеры. Силы межмолекулярного взаимодействия очень сильно зависят от расстояния между молекулами. С ростом этого расстояния силы отталкивания убывают быстрее, чем силы притяжения, а при уменьшении этого расстояния возрастают быстрее сил притяжения.
Силы отталкивания и притяжения хорошо описываются функцией 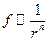 , причем сила отталкивания
, причем сила отталкивания  , а притяжения -
, а притяжения -  . Разная степень зависимости этих сил от расстояния между молекулами приводит к появлению положения устойчивого равновесия (рис.6.16а, кривая 3) и минимальной потенциальной энергии взаимодействия молекул. Положение устойчивого равновесия определяется равенством сил притяжения и отталкивания. Минимальная энергия взаимодействия двух молекул соответствует ее значению в положении равновесия, вокруг которого происходят их колебания (рис.6.16б).
. Разная степень зависимости этих сил от расстояния между молекулами приводит к появлению положения устойчивого равновесия (рис.6.16а, кривая 3) и минимальной потенциальной энергии взаимодействия молекул. Положение устойчивого равновесия определяется равенством сил притяжения и отталкивания. Минимальная энергия взаимодействия двух молекул соответствует ее значению в положении равновесия, вокруг которого происходят их колебания (рис.6.16б).
Как отмечалось выше, для реальных газов необходимо учитывать энергию взаимодействия молекул. Поскольку расстояния между молекулами велики, то учитывается их притяжение к стенкам сосуда, с которыми сталкиваются молекулы. Это увеличивает их давление ΔР на стенку сосуда на величину, обратно пропорциональную квадрату его объема: ΔР  .
.
Изменение давления в результате их взаимодействия со стенкой сосуда N молекул составляет:
 (6.7.1)
(6.7.1)
К тому же, объем молекул хоть и мал, все же отличен от нуля и составляет конечную величину – b.
|
|
|
В этом случае уравнение Менделеева - Клапейрона для одного моля газа приобретает вид:
 . (6.7.2)
. (6.7.2)
Давление молекул на стенку сосуда в этом случае составляет:
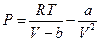 . (6.7.3)
. (6.7.3)
Без учета взаимодействия молекул соотношение (6.7.2), иногда называемое уравнением состояния Клаузиуса, приобретает вид:
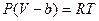 . (6.7.4)
. (6.7.4)

Рис.6.16. Взаимодействие между молекулами (а): 1 - силы отталкивания, 2- силы притяжения, 3 – их суммарное действие. Положение минимума энергии взаимодействия молекул (б).
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 292; Нарушение авторских прав?; Мы поможем в написании вашей работы!