
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон диффузии
|
|
|
|
Если в стакан с водой аккуратно влить каплю пищевого красителя, то можно заметить, что вся вода начинает окрашиваться. Этот процесс может занять несколько часов, но, в конечном счете, вода в стакане окрасится равномерно. Вам слышен запах духов от гостей, пришедших к вам в квартиру. Эти явления и многие другие обусловлены законом диффузии. Это смешивание обусловливается хаотическим движением молекул и называется диффузией. Диффузия имеет место и в твердых телах, и в жидкостях, и в газах.
Из некоторого источника при диффузии молекулы движутся хаотически во все стороны. Чем дальше от источника, тем меньше количество распространяющихся молекул. Возникает разница концентраций молекул вблизи источника и вдали от него. Поэтому возникает результирующий поток молекул от источника.
Физиолог Адольф Фик в 1855 году экспериментально установил, что поток частиц J через единичную площадку прямо пропорционален изменению концентрации вещества на единицу длины:
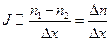 , (6.11.1)
, (6.11.1)
где величина  называется градиентом концентрации.
называется градиентом концентрации.
Закон диффузии Фика имеет вид:
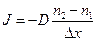 , (6.11.2)
, (6.11.2)
где n1 и n2 – концентрация молекул вблизи источник в точке 1 и дальше от него в точке 2.
или в дифференциальной форме:
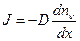 , (6.11.3)
, (6.11.3)
где D – коэффициент диффузии, который измеряется в м2/c.
Поток J представляет собой число молекул, пересекающих единицу площади за единицу времени. Концентрация вещества измеряется в . Вместо числа молекул в определении потока частиц и концентрации молекул может использоваться их масса. Тогда поток J измеряется в единицах
. Вместо числа молекул в определении потока частиц и концентрации молекул может использоваться их масса. Тогда поток J измеряется в единицах  , а концентрация - в кг/м3.
, а концентрация - в кг/м3.
Процесс диффузии будет различаться для случаев, когда давление в области диффузии, то есть во всех точках вокруг источника одинаково (такой процесс называется самодиффузией), и когда оно различно. Во втором случае коэффициент диффузии будет выше. Он будет складываться из коэффициента самодиффузии и диффузии вследствие разности давлений.
|
|
|
Коэффициент диффузии связан со средней длиной свободного пробега  молекул диффундирующего газа. Предполагая, что диффузия во всех направлениях одинакова, вдоль одной из осей координат будет двигаться третья часть молекул. Это приводится на рис.6.22.
молекул диффундирующего газа. Предполагая, что диффузия во всех направлениях одинакова, вдоль одной из осей координат будет двигаться третья часть молекул. Это приводится на рис.6.22.
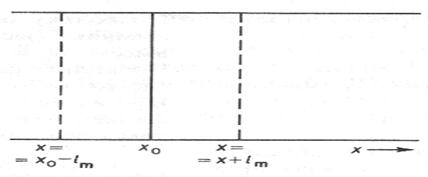
Рис.6.22. К выводу закона диффузии.
Причем в одном направлении вдоль оси двигается только половина молекул, другая половина двигается в противоположном направлении. Таким образом, потоки молекул вдоль одной из осей координат на рис.6.22 составляют:
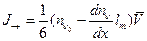
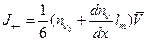 .
.
Разность этих потоков молекул в обе стороны от координаты 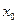 составляет:
составляет:
 . (6.11.4)
. (6.11.4)
Это выражение представляет собой, закон, полученный Фиком.
Коэффициент диффузии в газах описывается выражением:
 , (6.11.5)
, (6.11.5)
где 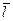 и
и  соответственно средняя длина свободного пробега, и средняя скорость молекул.
соответственно средняя длина свободного пробега, и средняя скорость молекул.
В некоторых случаях для смесей газов закон Фика удобно записывать через парциальные давления. Учитывая:
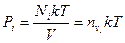 (6.11.6)
(6.11.6)
Выражая из (6.11.6) концентрацию молекул 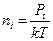 и подставляя ее в (6.11.4), получим:
и подставляя ее в (6.11.4), получим:
 (6.11.5)
(6.11.5)
В таблице 6.1 приведены примеры коэффициентов диффузии для некоторых газов и жидкостей.
Таблица 6.1. Коэффициенты диффузии D при 20 0С и давлении 1 атм.
| Вид молекул | Среда | 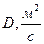
|
| Воздух | 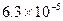
|

| Воздух | 
|

| Вода | 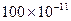
|
| Гемоглобин | Вода | 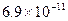
|
| Аминокислота | Вода | 
|
| ДНК | Вода | 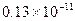
|
Пример существования процесса диффузии: если прижать друг к другу хорошо отполированный медный и свинцовый брусок, то спустя некоторое время, можно заметить, что в медном бруске будут частицы свинца, а в свинцовом - меди. Если на балконе какой – либо из квартир соседей кто-то курит, то вы быстро почувствуете запах, так как молекулы табачного дыма распространяются с большой скоростью. Распространение, например, запаха духов по комнате – это тоже процесс диффузии.
|
|
|
Диффузия лежит в основе многих процессов, происходящих в живых организмах, в частности, в клетках. Диффузия – один из основных механизмов, в результате которых происходит распространение медицинских препаратов в живых тканях.
Контрольные вопросы к лекции №6:
1. Какие Вам известны способы описания условий существования
веществ? Какие величины называют параметрами состояния?
2. Как развивались представления об атомной структуре вещества?
3. Что такое температура? Как работает термометр?
4. Сформулируйте нулевое начало термодинамики.
5. Объясните причины возникновения линейного и объемного расширения тел.
6. Почему при замерзании бутылку с водой или металлическую трубу может разорвать?
7. Что такое идеальный газ? Перечислите основные законы идеального газа?
8. Как вычислить универсальную газовую постоянную?
9. Запишите основное уравнение молекулярно – кинетической теории. В чем его смысл?
10. Напишите аналитический вид и объясните смысл распределения молекул по скоростям.
11. Рассчитайте среднюю, среднеквадратичную и наиболее вероятную скорость молекул.
12. Напишите уравнение Ван-дер-Ваальса и объясните значение его переменных.
13. Что Вы знаете о фазовом состоянии веществе?
14. Как зависит плотность воды и пара от температуры?
15. В чем физический смысл критической температуры?
16. Приведите пример фазовой диаграммы. Что такое тройная точка?
17. Дайте объяснение парообразованию. В чем смысл кипения?
18. Дайте определение абсолютной и относительной влажности, точке росы.
19. В чем значение закона диффузии? Какова связь коэффициента диффузии и длины свободного пробега молекул?
[1] статистическая механика – это раздел физики, рассматривающий (изучающий) закономерности движения большого числа частиц.
[2] Греческий философ Демиокрит жил в период ок.460-370 гг. до н.э. Мельчайшие частицы вещества называл атомами. Это слово происходит от греческого слова атомос – неделимый. Он считал, что всех предметов и веществ состоит в различии атомов, из которых они состоят. Он являлся учеником и последователем греческих философов Анаксагора (500-428 гг. до н.э.), высказавшем мысль о существовании «неразрушимых элементов» и Левкиппа (V век до н.э.), подхватившим идеи атомистики.
|
|
|
[3] Этот закон был установлен французским химиком Прустом в начале ХIХ века.
[4] Джон Дальтон, английский химик, проживавший в 1766-1844гг. В 1803 году установил закон кратных отношений.
[5] Впервые мысль о постоянстве произведения давления на объем была высказана английским физиком Р.Тоунли. Такие же следования проводил врач Г.Пауэр. Английский физик Роберт Бойль провел исследования в широких пределах и опубликовал результаты в 1662 году, а независимо от него французский физик Э.Мариотт опубликовал свои исследования в 1676 году.
[6] Гипотеза о пропорциональности давления температуре была высказана французским физиком Г.Амонтоном в 1702 году, а сто лет спустя французский физик Ж.Л.Гей- Люссак получил математическое выражение этого закона. Им же был открыт в 1802 году и закон пропорциональности объема газа температуре. Однако первым его открыл другой французский физик Ж.Шарль, который свои результаты не опубликовал. По инициативе Гей-Люссака, благодаря его благородству, закон стали называть законом Шарля.
[7] Это уравнение впервые было получено в 1874 году русским ученым Д.И.Менделеевым на основе обобщения результатов исследований французского физика Б.П.Клайперона и записано в такой форме.
[8] Гипотеза впервые была им сформулирована в 1811 году. В закон она превратилась в 1863 году после того, как была доказана Клаузиусом.
[9] В 1845 году английский ученый Дж. Уотерстон выдвинул идею о возможности представления молекул газа в виде твердых, абсолютно упругих шариков, сталкивающихся между собой и со стенками сосуда.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2178; Нарушение авторских прав?; Мы поможем в написании вашей работы!