
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Неравенство Клаузиуса
|
|
|
|
Совместное применение первой и второй теорем Карно позволяет получить следующее неравенство:
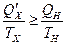
подразумевая, что для обратимых процессов выполняется равенство, а для необратимых - неравенство. По договоренности об обозначениях 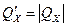 , т.е.
, т.е. 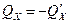 , откуда
, откуда 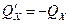 .
.
Следовательно
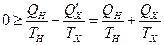 .
.
В общем случае циклический процесс можно разделить на некоторое множество участков, на которых подводится или отводится теплота:
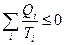 .
.
Величина 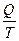 называется приведённым количеством теплоты (Дж/К). Она численно равна полученному системой при абсолютной температуре Т количеству теплоты, делённому на эту температуру.
называется приведённым количеством теплоты (Дж/К). Она численно равна полученному системой при абсолютной температуре Т количеству теплоты, делённому на эту температуру.
В пределе для элементарных количеств теплоты имеем:
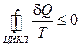 .
.
(Кружок в интеграле показывает, что процесс круговой.)
Это соотношение носит название неравенства Клаузиуса - суммарное количество приведенной теплоты в любом замкнутом цикле для любой термодинамической системы не может быть положительным.
Знак равенства можно поставить только для обратимых процессов: 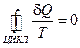 .
.
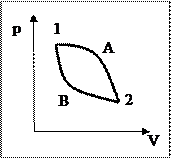 Рассмотрим произвольный обратимый циклический термодинамический процесс, состоящий из двух процессов 1А2 и 2В1. Суммарное приведённое количество теплоты для такого процесса в соответствии с равенством Клаузиуса равно нулю:
Рассмотрим произвольный обратимый циклический термодинамический процесс, состоящий из двух процессов 1А2 и 2В1. Суммарное приведённое количество теплоты для такого процесса в соответствии с равенством Клаузиуса равно нулю:
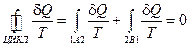 .
.
С учетом того, что при смене направления протекания процесса 2В1 на противоположное 1В2, что возможно вследствие обратимости этого процесса, изменяется знак перед вторым интегралом в последнем равенстве: 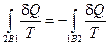 , получаем
, получаем
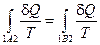 .
.
Из полученного соотношения следует, что для обратимых процессов значение интеграла не зависит от формы траектории, по которой происходит процесс, а определяется только начальным и конечным равновесными состояниями термодинамической системы. Поэтому элементарное количество приведенной теплоты для обратимого процесса является полным дифференциалом некоторой функции S равновесного состояния системы, зависящей только от состояния термодинамической системы:
|
|
|
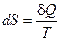 ,
,
и изменение которой равно суммарному количеству приведённой теплоты в равновесном процессе: 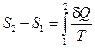 . Эта величина S называется термодинамической энтропией и измеряется в Дж/К. Энтропия является аддитивной величиной – энтропия системы равна сумме энтропий частей, входящих в систему.
. Эта величина S называется термодинамической энтропией и измеряется в Дж/К. Энтропия является аддитивной величиной – энтропия системы равна сумме энтропий частей, входящих в систему.
Теперь рассмотрим циклический процесс, одна половина которого 1A2 – необратимый процесс, а вторая половина 2B1 – обратимый процесс. Тогда должно быть 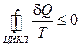 .
.
Действуя по аналогии, получаем
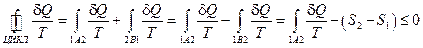
т.е. 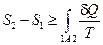 .
.
Если система является адиабатически изолированной, то 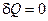 , поэтому
, поэтому 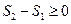
В адиабатически изолированной системе энтропия не убывает. Это закон возрастания энтропии для адиабатически изолированной термодинамической системы: в такой системе энтропия не может убывать - она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс. Отсюда следует смысл энтропии - энтропия служит мерой необратимости процесса. Она показывает направление протекания необратимого процесса.
 Пример. Наша Вселенная является адиабатически изолированной системой (в силу единственности). Поэтому суммарная энтропия Вселенной возрастает. Рано или поздно она достигнет максимального значения, и все тепловые процессы прекратятся. Как говорят, наступит т епловая смерть Вселенной.
Пример. Наша Вселенная является адиабатически изолированной системой (в силу единственности). Поэтому суммарная энтропия Вселенной возрастает. Рано или поздно она достигнет максимального значения, и все тепловые процессы прекратятся. Как говорят, наступит т епловая смерть Вселенной.
Пример. Рассмотрим цикл Карно в переменных температура – энтропия (см.рис.). П роцесс 1-2 – изотермический. В этом процессе ТН= const. Т.к. в этом процессе 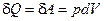 , то
, то 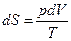 . Считая, что рабочее тело является идеальным газом, из уравнения Менделеева-Клапейрона находим
. Считая, что рабочее тело является идеальным газом, из уравнения Менделеева-Клапейрона находим 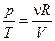 . Поэтому
. Поэтому 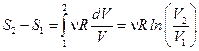 . Т.к. газ расширяется, то
. Т.к. газ расширяется, то 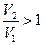 ,и энтропия увеличивается.
,и энтропия увеличивается.
|
|
|
Процесс 2-3 – адиабатический – газ расширяется без теплообмена: dQ=0, следовательно dS =0, откуда S = const.
Процесс 3-4 – изотермический – газ отдает тепло холодильнику-термостату: ТХ= const. Т.к. газ сжимается, то
 .
.
Процесс 4-1 – адиабатический – газ сжимается без теплообмена: S = const.
Т.к. 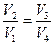 , то полное изменение энтропии за цикл
, то полное изменение энтропии за цикл 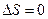 , как и должно быть в равновесном процессе.
, как и должно быть в равновесном процессе.
Замечание. Закон возрастания энтропии означает, что в замкнутой системе энтропия не может уменьшаться без внешнего воздействия. Если на систему оказывается воздействие (т.е. система незамкнутая), то энтропия может убывать.
Третье начало термодинамики (теорема Нернста).
Энтропия определена с точностью до произвольного слагаемого
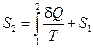 .
.
Если этому слагаемому S 1 придать какое-то конкретное значение, то можно говорить об абсолютном значении энтропии.
Теорема Нернста. (Справедлива только для равновесных систем.)
При стремлении температуры любой равновесной системы к абсолютному нулю её энтропия стремится к постоянной величине, которую можно принять равной нулю. Теплоёмкости также стремятся к нулю:
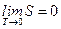 и
и 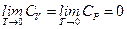 .
.
Следствие: невозможно достичь состояния с абсолютным нулем температуры 0 К.
Действительно, при T®+0 теплоёмкость системы также стремится к нулю, что делает процесс отвода теплоты невозможным. Можно лишь асимптотически приближаться к 0 К.
Следствие: Уравнение Менделеева-Клапейрона неприменимо для описания идеального газа при T®0 К.
Действительно, 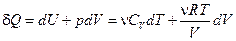 .
.
Тогда 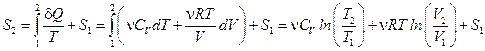 .
.
Получаем, что при T®0 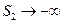 , что противоречит третьему началу термодинамики. Это делает невозможным применение уравнения Менделеева-Клапейрона для описания газа при температурах, близких к абсолютному нулю. Состояние газа при Т®0 называется вырожденным, и для его описания требуется применение законов, полученных на основе квантовой статистики.
, что противоречит третьему началу термодинамики. Это делает невозможным применение уравнения Менделеева-Клапейрона для описания газа при температурах, близких к абсолютному нулю. Состояние газа при Т®0 называется вырожденным, и для его описания требуется применение законов, полученных на основе квантовой статистики.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1839; Нарушение авторских прав?; Мы поможем в написании вашей работы!