
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Статистическое обоснование второго начала термодинамики
Для равновесных систем вероятность возникновения флуктуации обратно пропорциональна её величине – чем больше величина отклонения, тем меньше вероятность её возникновения. Например, вероятность того, что все молекулы газа соберутся в одной части сосуда очень мала, т.е. процесс самопроизвольного перехода в неравновесное состояние маловероятен, что согласуется со вторым началом термодинамики. Всякий самопроизвольный необратимый процесс, переводящий систему из неравновесного состояния в равновесное, с гораздо большей вероятностью протекает в природе, чем обратный ему процесс. Необратимыми являются те процессы, вероятность протекания которых в прямом направлении выше, чем в обратном. Это приводит к возникновению в природе преимущественного направления протекания термодинамических процессов. Термодинамической величиной, характеризующей направление протекания процесса, является энтропия.
Пусть в сосуде, объем которого V0 находится одна молекула. Тогда вероятность того, что она будет находиться в части сосуда, объём которой V, равна 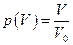 . Если молекул две, то
. Если молекул две, то 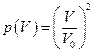 , а если их число равно N, то
, а если их число равно N, то 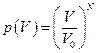 . Поэтому отношение вероятностей для разных объёмов равно
. Поэтому отношение вероятностей для разных объёмов равно 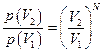 .
.
С другой стороны, рассмотрим изотермическое расширение идеального газа от объёма V1 до объёма V2. В этом случае dU =0, поэтому dQ=d A =n RT ×dV. Следовательно,
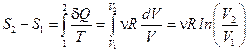 .
.
Однако, 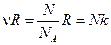 , поэтому
, поэтому 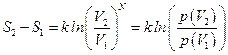 .
.
Из этой формулы следует, что энтропия состояния пропорциональна вероятности того, что система придет в это состояние.
Статистическим весом G (часто обозначают также W) макроскопического состояния называется величина, численно равная количеству равновесных микросостояний, с помощью которых может быть реализовано рассматриваемое макросостояние. Статистический вес пропорционален вероятности G ~ p. Если система состоит из N частиц, каждая из которых может находится в одном из К дискретных состояний, то статистический вес системы равен 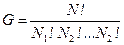 , а соответствующая вероятность
, а соответствующая вероятность 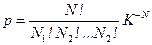 , где Ni – число частиц в состоянии с номером i, и
, где Ni – число частиц в состоянии с номером i, и 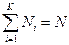 .
.
Данное рассуждение может служить обоснованием для формулы Больцмана, связывающей энтропию со статистическим весом
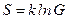 .
.
Замечание. Для статистической энтропии также выполняется закон аддитивности – если систему разбить на две невзаимодействующие между собой части, то 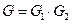 и
и
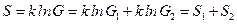 .
.
Замечание. С законом возрастания энтропии связана «тепловая смерть» Вселенной, т.е. состояние с максимальной энтропией и максимальным статистическим весом. Но в такой системе должны происходить флуктуации. Сегодняшнее состояние Вселенной является такой флуктуацией.
|
Дата добавления: 2014-01-06; Просмотров: 5208; Нарушение авторских прав?; Мы поможем в написании вашей работы!