
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические соединения
|
|
|
|
Характерными особенностями химических соединений являются:
- кристаллическая решетка отличается от решеток компонентов, образующих соединение (рис.5.4). Атомы в решетке химического соединения располагаются упорядоченно, т.е. атомы каждого компонента расположены закономерно и по определенным узлам решетки. Большинство химических соединений имеют сложную кристаллическую структуру;
- в соединении всегда сохраняется простое кратное соотношение компонентов. Это позволяет выразить их состав простой формулой АnBm, где А и В – соответствующие элементы; n и m – простые числа. Например, у CuAl2 соотношение количества атомов Cu и Al – 1: 2;
- свойства соединения резко отличаются от свойств образующих его компонентов;
- температура плавления (диссоциации) постоянная;
- образование химического соединения сопровождается значительным тепловым эффектом.
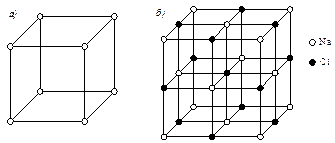
Рис. 5.4. Кристаллические решетки: а - Na; б – химического соединения NaCl
Химические соединения делятся на две группы:
- соединения с нормальной валентностью, т.е. соединения металлов с типичными неметаллами. Такими соединениями являются оксиды, сульфиды, хлориды. В сплавах эти соединения присутствуют в виде так называемых неметаллических включений;
- металлические соединения, которые отличаются разнообразием типов межатомных связей (металлической, ковалентной, ионной) и благодаря этому характеризуются металлическим блеском, электропроводностью и в отдельных случаях сверхпроводимостью. Металлические соединения при обычных температурах тверды и хрупки, однако при нагреве до температур, равных 70…90 % от температуры плавления, эти соединения очень пластичны, что объясняется увеличением при нагреве доли металлической связи между атомами.
|
|
|
При промежуточных значениях разности атомных размеров также возможно образование химических соединений. К ним относятся:
- Фазы Лавеса (устойчивое химическое соединение с ионным типом связи), образующееся между элементами различной природы, атомные диаметры которых находятся приблизительно в соотношении 1: 1,2. Эти фазы удовлетворяют условиям, характеризующим химическое соединение с соотношением атомов, которое укладывается в формулу АВ2. Например: MgZn2, MgNi2..
Фазы Лавеса встречаются как упрочняющие интерметаллидные фазы в жаропрочных сплавах.
- Фазы внедрения, которые образуют металлы переходных групп с металлоидами, имеющими малый атомный радиус. Фазы внедрения образуются, если отношение атомного радиуса металлоида к атомному радиусу металла равно или меньше 0,59. В отличие от фаз Лавеса, при образовании фаз внедрения металлы образуют простые кристаллические решетки (обычно ОЦК, ГЦК, ГПУ). В этом случае образуются химические соединения, которые имеют соотношение атомов, укладывающиеся в простые формулы. Например:
Ме4Х: Fe4N, Mn4N;
Ме2Х: W2C, Mo2C, Fe2N;
МеХ: WC, VC, TiC, NbC, TiN.
Карбиды и нитриды, встречающиеся в сталях, являются фазами внедрения.
5.3. Электронные соединения (фазы Юм – Розари)
Этот вид соединений образуется между двумя металлами группы: Cu, Ag, Au, Fe, Co, Ni, Pt, Pd c металлами группы Be, Zn, Cd, Al, Sn, Si. Соединения этого типа имеют определенное отношение числа валентных электронов к числу атомов, т.е. определенную электронную концентрацию. Каждому соотношению числа валентных электронов и числу атомов соответствует определенный тип кристаллической решетки: при соотношении 3: 2 (1,5) образуется ОЦК-решетка (b - фаза). Например, химические соединения Cu-Zn, Cu-Be, Cu5Sn, NiAl; при соотношении 21: 13 (1,62) образуется сложная кубическая решетка (g - фаза). Например, химические соединения Cu5Zn8, Cu3Cd8, Cu81Sn8; при соотношении 7: 4 (1,75) образуется гексагональная решетка (e - фаза). Например, химические соединения CuZn3, CuCd3, Cu3Si, Cu3Sn.
|
|
|
При сплавлении переходных металлов, имеющих близкие размеры атомов, образуются фазы переменного состава (s - фаза). Эти фазы имеют частично упорядоченную сложную решетку.
В железных сплавах, содержащих больше 20 % Cr, которые используются как коррозионно-стойкие конструкционные материалы, очень медленное охлаждение из области твердого раствора или изотермические выдержки при 800-600 оС приводят к образованию кристаллов s - фазы, которое сопровождается резким увеличением твердости и охрупчиванием сплавов.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 613; Нарушение авторских прав?; Мы поможем в написании вашей работы!