
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Т. 2 л. 2 фтор
|
|
|
|
Получение платиновых металлов
Основную массу получаемых платиновых металлов извлекают из анодного шлама образующегося при электролитическом рафинировании никеля и меди. Отделение платиновых металлов друг от друга (аффинаж) производят сложной химической переработкой, которая слагается из следующих основных операций
1. На анодный шлам (после обогащения) действуют царской водкой при нагревании. Рt, Рd, Rh, Ir и Ru переходит в раствор в виде Н2[РtСl6], Н2[РdС14], Н3[RhСl6], Н2[IrСl6] и Н2[RuСl6], а Оs остается с нерастворимыми минеральными остатками шлама.
2. Из раствора действием NН4Сl сначала осаждают (NН4)2[РtСl6], а затем (NН4)2[IrС16] и (NН4)2[RuСl6]. После ряда операций действием Н3N осаждают [Рd(NН3)2С12] и [Рh(NН3)3С13]. Не растворившийся в царской водке осадок сплавляют с ВаО2. Образующийся при этом ОsO4 отгоняют, Аналогичным образом поступают для отделения рутения от иридия.
3. При прокаливании полученных соединений в восстановительной атмосфере (часто в присутствии водорода) выделяют свободные металлы.
Платиновые металлы высокой степени чистоты получают многократным повторением операций перевода их в раствор, осаждения и разложения соответствующих соединений.
В последнее время для получения чистых платиновых металлов все большее значение начинает приобретать способ разделения их с помощью ионообменных смол.
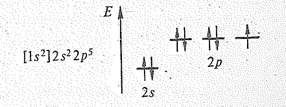
Фтор в невозбужденном состоянии имеет электронную конфигурацию: 1 s 22 s 22 p 5.
Наличием одного непарного электрона обуславливается сходство фтора с водородом. Однако различие в общем числе валентных электронов и орбиталей предопределяет значительное отличие этих элементов друг от друга. Степень окисления фтора как самого электроотрицательного элемента (4,0) принимается равной –1. Максимальная валентность фтора, согласно теории валентных связей, как и других элементов 2-го периода, равна четырем.
|
|
|
Фтор – довольно распространенный элемент, и его содержание на Земле составляет ~ 0,03 мол. доли, %. Из минералов фтора наибольшее значение имеют СаF2 — плавиковый шпат (флюорит), Nа3А1F6 — криолит и Са5(РО4)3F— фторапатит. Фтористые соединения содержатся в организме человека (в основном в зубах и костях). В природе встречается только один изотоп 19F. Искусственно получены малоустойчивые изотопы (с массовыми числами от 16 до 21).
Простое вещество. Подобно водороду фтор образует двухатомные молекулы F2, что соответствует следующей электронной конфигурации:
(ssсв)2 (ss разр)2 (sхсв)2 (py, zсв)4 (py, zразр)4.

 Поскольку на связывающих орбиталях имеется на два электрона больше, чем на разрыхляющих, порядок связи в молекуле F2 принимается равным 1.
Поскольку на связывающих орбиталях имеется на два электрона больше, чем на разрыхляющих, порядок связи в молекуле F2 принимается равным 1.
Молекула фтора F2 имеет относительно небольшую массу и достаточно подвижна, поэтому фтор в обычных условиях — газ (светло-желтого цвета), обладает низкой температурой плавления (—223 °С) и кипения (—187 oС).
Фтор исключительно активен химически, он — сильнейший окислитель. Высокая химическая активность фтора объясняется тем, что его молекула имеет низкую энергию диссоциации (159 кДж/моль), в то время как химическая связь в большинстве соединений фтора отличается большой прочностью (порядка 200—600 кДж/моль). Кроме того, энергия активации реакций с участием атомов фтора низка (≤ 4 кДж/моль). По образному выражению акад. А. Е. Ферсмана, фтор «всесъедающий». В атмосфере фтора горят такие стойкие вещества, как стекло (в виде ваты), вода:
SiO2 + 2F2 = SiF4 + O2; 2Н2O + 2F2 = 4НF + O2
В этих реакциях в качестве одного из продуктов горения образуется кислород (!), т. е фтор как окислитель сильнее кислорода.
Исключительно активно протекает взаимодействие фтора с большинством простых веществ. С серой и фосфором он взаимодействует даже при температуре жидкого воздуха (—190 °С):
|
|
|
S + 3F2 = SF6, DНo298 = — 1207 кДж/моль;
2Р + 5F2 = 2РF5, DНo298 = —3186 кДж/моль.
Фтор окисляет некоторые так называемые инертные газы:
Хе + 2F2 = ХеF4, DНo298 = – 252 кДж/моль.
Непосредственно фтор не взаимодействует лишь с гелием, неоном и аргоном.
Вследствие высокой химической активности фтор вызывает коррозию почти всех материалов. В качестве материала аппаратуры для получения фтор, его хранения и перевозки используется никель (и некоторые его сплавы), который устойчив к действию фтора за счет образования защитной пленки NiF2. В целом проблема эта ныне разрешена, и фтор перевозится в больших количествах в гигантских автоцистернах.
Из-за высокой окислительной активности фтора и большой прочности его соединений фтор получают в свободном состоянии электролизом его расплавленных соединений. Для этих целей обычно используют эвтектическую смесь НF – КF или фторогидрогенаты калия (например K[HF2] - дифторогидрогенат калия)..
Широкое применение фтора началось в связи с работами по разделению изотопов урана (в виде 235UF6 и 238UF6) диффузионным методом. В настоящее время фтор широко применяется для синтеза различных хладоагентов и полимерных материалов—фторопластов, отличающихся высокой химической стойкостью. Жидкий фтор и ряд его соединений применяются в качестве окислителя ракетного топлива.
Соединения со степенью окисления фтора —1. В соответствии с закономерным изменением характера элементов по периодам и группам периодической системы закономерно изменяются и свойства фторидов, например:
| NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 | (ClF5) | |
| Химическая природа | основная | амфотерная | кислотная | ||||
| Анионные комплексы | - | - | AlF63- | SiF62- | PF6- | SF60 | (ClF6-) |
Ионные фториды кристаллические вещества с высокой температурой плавления. Координационное число иона фтора 6 (NаF) или 4 (СаF2). Ковалентные фториды газы или жидкости.
Промежуточное положение между ионными и ковалентными фторидами занимают фториды с высокой степенью полярности связи, которые можно назвать ионно-ковалентными соединениями. К последним, например, можно отнести кристаллические ZnF2, МnF2, СоF2, NiF2, в которых эффективные заряды электроположительных атомов составляют 1,56; 1,63; 1,46; 1,40 соответственно.
|
|
|
Многие фториды металлов в низких степенях окисления получают действием раствора HF на оксиды, гидроксиды, карбонаты и пр., например:
ЗНF + А1(ОН)3 = А1F3 + ЗH2О
Фториды неметаллов и металлов в высоких степенях окисления получают фторированием простых веществ или низших фторидов, например:
СlF + F2 = С1F3.
Большинство кристаллических фторидов нерастворимо в воде. Хорошо растворяются лишь фториды s -элементов I группы (кроме LiF), а также АgF, НgF2, SnF2 и некоторые другие.
По химической природе ионные фториды являются основными соединениями, а ковалентные фториды — кислотными. Так в реакции
2NаF + SiF4 = Nа2[SiF6]
основный кислотный гексафторосиликат натрия
ионный NаF выступает в качестве донора, а ковалентный SiF4 — в качестве акцептора электронных пар, носителем которых является фторид-ион F-. По мере усиления кислотной природы фторидов, например в ряду МgF2 — АIF3 — SiF4, их взаимодействию с основными фторидами отвечает увеличение отрицательного значения DGo:
NаF (к) + МgF (к) = NаМgF3 (к), DGo298 = — 13,96 кДж/моль;
NаF (к) + 1/3 АlF3 (к) = 1/3 Nа3АlF6 (к), DGo298 = —З0,9 кДж/моль;
NаF (к) + 1/2 SiF4 (г) = 1/2 Nа2SiF6 (к), DGo298 = —50,99 кДж/моль.
Основные фториды при гидролизе создают щелочную среду, а кислотные фториды — кислотную
SiF4 + 3Н2O = Н2SiО3 + 4НF
Амфотерные фториды взаимодействуют как с основными, так и с кислотными фторидами. В последнем случае образуются смешанные фториды, например:
2КF + ВеF2= К2[ВеF4]
(ВеF2 как кислотное соединение)
ВеF2 + SiF4 = Be[SiF6]
(ВеF2 как основное соединение)
Комплексные фториды весьма разнообразны. Координационное число по фтору для элементов 2-го периода равно 4, для элементов других периодов типично координационное число 6. Кроме того, встречаются комплексные фториды, в которых координационное число комплексообразователя равно 7, 8 и 9, например:
К2[ВеF4] К3[А1F6] К2[NbF7] К2[ReF9]
Эти же примеры показывают, что во фторокомплексах стабилизируется. высшая степень окисления центральных атомов.
Производные фторокомплексов представляют собой преимущественно ионные соединения либо относятся к смешанным (полимерным) фторидам (например, ВеSiF6). Соединения с водородом типа НВF4, НРF6, Н2SiF6 в свободном состоянии неустойчивы. Их водные растворы — очень сильные кислоты.
|
|
|
Молекула фторида водорода НF сильно полярна (m = 0,64 х 10-29 Кл×м, dН = 0,4+, dF = 0,4—) и имеет большую склонность к ассоциации за счет водородных связей в зигзагообразные цепи. Поэтому фторид водорода в обычных условиях — бесцветная жидкость (т. пл. —83 °С, т. кип. 19,5 оС) с резким запахом, сильно дымящая на воздухе. Даже в состоянии газа фторид водорода состоит из смеси полимеров Н2F2, Н3F3, Н4F4, Н5F5, Н6F6. Простые молекулы НF существуют лишь при температурах выше 90°С. Вследствие высокой прочности связи (энергия диссоциации 565 кДж/моль) термический распад НF на атомы становится заметным выше 3500 oC.
Фторид водорода обычно получают действием серной кислоты на флюорит:
СаF2 + Н2SО4 = СаSO4 + 2НF
Собственная ионизация жидкого НF незначительна (К = 2,07×10-11). Она происходит путем перехода протона (или соответственно иона фтора) от одной молекулы к другой, сопровождающегося превращением водородной связи из межмолекулярной в межатомную и в ковалентную. При этом образуются сольватированные фтороний -ион FH2+ и фторогидрогенат -ион НF2- по схеме
Н—F×××Н—F×××Н—F «[H—F—H]+ + [F—Н—F]-
Или
HF×××HF×××HF «FH2+ + HF2-.
Жидкий фторид водорода —— сильный ионизирующий растворитель. В нем хорошо растворяются вода, фториды, сульфаты и нитраты s -элементов I группы, несколько хуже аналогичные соединения s -элементов II группы, При этом растворенные вещества, отнимая от молекул НF протоны, увеличивают концентрацию отрицательных ионов (HF-2), т. е. ведут себя как основания. Например:
КNO3 + 2НF «К+ + НNO3 + HF2-
Даже НNО3 в этих условиях ведет себя как основание:
НNО3 + 2НF «NО3Н2+ + HF2-
а индифферентный в воде этиловый спирт в жидком фториде водорода оказывается таким же сильным основанием, как КОН в воде:
С2Н5ОН + 2НF «С2Н5OН2+ + HF2-
В жидком НF ведут себя как кислоты вещества — акцепторы фторид-ионов, например BF3, SbF5:
BF3 + 2НF = FH2+ + ВF4-
SbF5 + 2НF = FH2+ + SbF6-
При растворении кислот увеличивается концентрация положительных фтороний-ионов FH2+.
Амфотерными соединениями в жидком НF являются, например, фториды алюминия и хрома (III):
ЗNаF + АIF3 = 3Nа+ + А1F63-
(АIF3 как кислотное соединение)
АlF3 + ЗВF3 = А13+ + 3ВF4-
(АIF3 как основное соединение)
Фторид водорода неограниченно растворяется в воде. При этом происходит ионизация молекул НF с образованием ионов ОН+3 и F-. Последние, взаимодействуя с молекулами НF, образуют фторогидрогенат-ионы
НF + Н2O «OH+3 + F-, К = 7,2×10-4
НF + F- «HF-2, К = 5,1
или суммарно
2HF + Н2О «OH+3 + HF-2
Раствор НF (плавиковая кислота) является кислотой средней силы. В растворе содержатся также комплексные ноны Н2F3-, Н3F4-, НnFn+1-. Поэтому при нейтрализации растворов плавиковой кислоты образуются не фториды, а фторогидрогенаты типа К[НF2] (т. пл. 239 °С), К[Н2F3] (т. пл. 62 °С), К[Н3F4] (т. пл. 66 °С), К[Н4F5] (т. пл. 72 °С). Эти соединения, как правило, хорошо кристаллизуются и плавятся без разложения Полимерные гидрогенат-ионы имеют зигзагообразную форму. Они образованы за счет водородной связи. Термическое разложение фторогидрогенатов используется для получения НF:
К [НnFn+1] = К [Нn-1Fn] + НF
Характерная особенность плавиковой кислоты ее способность взаимодействовать с диоксидом кремния:
SiO2 (к) + 4НF (р) = SiF4 (г) + 2Н2O (ж)
Поэтому ее не хранят в стеклянной посуде, а обычно в сосудах из свинца, каучука, полиэтилена или парафина. Она токсична, при попадании на кожу вызывает плохо заживающие болезненные язвы.
Плавиковая кислота применяется для травления стекла, удаления песка с металлического литья, получения фторидов и т. д. Фторид водорода в основном используется в органическом синтезе.
Соединения кислорода (II). Можно считать, что электроположительная поляризация атомов кислорода проявляется в соединениях с фтором, а также в ионе О2+. Некоторые примеры фторопроизводных кислородных соединений приведены в табл. 2.
Простейший представитель такого рода соединений — дифторид кислорода ОF2: его получают при быстром пропускании фтора через 2%-ный раствор щелочи:
2F2 + 2NaOH = OF2 + 2NaF + H2O

Молекула ОF2 имеет угловую форму (d OF = 0,139 нм, ÐFОF = 104° 16’, m= 0,1 × 10-29 Кл×м.) Дифторид кислорода ядовитый газ бледно-желтого цвета, термически устойчив до 200—250 °С, сильный окислитель, эффективный фторирующий агент. С водой и щелочами диспропорционирует:
OF2 + H2O = O2 + 2HF; OF2 + 2NaOH = 2NaF + O2 + H2O
В диоксидифториде О2F2 радикал О22+ ковалентно связан с атомами фтора. Молекула О2F2 диамагнитна. Это соединение образуется (в виде красной летучей жидкости) в результате непосредственного взаимодействия простых веществ в электрическом разряде или под действием ионизирующих излучений при температуре жидкого воздуха (—190 °С). Согласно спектроскопическим данным молекула О2F2 (m = 0,48×10-29 Кл×м) по структуре аналогична Н2О2:

Соединение крайне неустойчиво, что определяется низкой энергией разрыва связи ОF (75 кДж/моль).
Получены также полиоксидифториды типа О4F2, О5F2 и О6F2, существующие лишь при низкой температуре (—190 °с). Предполагают, что их молекулы имеют цепное строение, например F—О—О—О—О—F. Термическая устойчивость полиоксидифторидов уменьшается с увеличением числа атомов в молекуле ОnF2 (n = 2 – 6).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1218; Нарушение авторских прав?; Мы поможем в написании вашей работы!