
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подгруппа калия
|
|
|
|
Натрий
Литий
Литий Li от остальных щелочных металлов отличает большее значение энергии ионизации и небольшой размер атома и иона. Литий по свойствам напоминает магний (диагональное сходство в периодической системе).
Для лития наиболее характерно образование ионной связи. Поэтому координационное число Li в соединениях в отличие от остальных элементов 2-го периода больше 4. Вместе с тем вследствие небольшого размера ион лития характеризуется высокой энергией сольватации, а в литийорганических соединениях литий образует ковалентную связь.
Литий достаточно широко распространен в земной коре (0,002 мол, доли, %). Природный литий состоит из двух стабильных изотопов: 6Li (7,3%) и 7Li (92,7%). Искусственно получены радиоактивные изотопы. Наибольшую ценность имеют минералы сподумен LiАl(SiO3)2, амблигонит LiАl(РО4)F и лепидолит Li2Аl2(SiО3)3(F,ОН)2.
Простое вещество. В виде простого вещества литий — мягкий серебристо-белый металл (Tпл. 179 °С, Ткип. 1350 °С). Из металлов он самый легкий (пл. 0,534 г/см3).
Литий высоко химически активен. С кислородом и азотом взаимодействует уже при обычных условиях, поэтому на воздухе тотчас окисляется, образуя темно-серый налет продуктов взаимодействия (Li2О, Li3N). При температуре выше 200 °С загорается. В атмосфере фтора и хлора, а также в парах брома и иода самовоспламеняется при обычных условиях. При нагревании непосредственно соединяется с серой, углем, водородом и другими неметаллами. Будучи накален, горит в СО2.
С металлами литий образует интерметаллические соединения. С магнием, алюминием, цинком и с некоторыми другими металлами, кроме того, образует ограниченные твердые растворы. Заметно отличаясь атомным радиусом от остальных щелочных металлов, дает с ними эвтектические смеси,
|
|
|
Литий придает сплавам ряд ценных физико-химических свойств. Например, у сплавов алюминия с содержанием до 1 % Li повышается механическая прочность и коррозионная стойкость, введение 2% Li в техническую медь значительно увеличивает ее электрическую проводимость и т. д.
По химической активности литий уступает некоторым металлам, хотя значение его стандартного. электродного потенциала наиболее отрицательное (Ео298 = —3,05 В). Это обусловлено большой энтальпией гидратации иона Li, что обеспечивает значительно большее смещение равновесия
Li (т) «Li+ (р) + e—
в сторону ионизации металла, чем это имеет место у остальных щелочных металлов. Для слабо сольватирующих растворителей (например, в расплавах солей) значение его электродного потенциала соответствует его меньшей химической активности в ряду щелочных металлов.
Литий энергично разлагает воду, выделяя из нее водород, еще легче взаимодействует с кислотами.
Получают литий электролизом расплава эвтектической смеси LiСl — КСl. Его хранят под слоем вазелина или парафина в запаянных сосудах.
Важнейшей областью применения лития является атомная энергетика. Его используют как источник получения трития:
63Li + 10 n = 31Н + 42Не
а также в качестве теплоносителя в атомных реакторах.
Соединения лития (I). Бинарные соединения лития — бесцветные кристаллические вещества; являются солями или солеподобными соединениями. По химической природе, растворимости и характеру гидролиза они напоминают производные кальция и магния. Из бинарных соединений и солей плохо растворимы LiF, Li2СО3, Li3РО4 и др.
Перекисные соединения для лития малохарактерны. Однако для него известны пероксид Li2О2, персульфид Li2S2 и перкарбид Li2С2.
Оксид лития Li2О — белое твердое вещество. Получается взаимодействием простых веществ. Активно реагирует с водой, образуя гидроксид. С кислотами, кислотными и амфотерными оксидами образует соли.
|
|
|
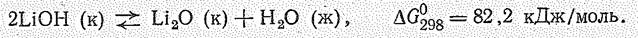 Гидроксид LiОН — бесцветное очень гигроскопическое вещество, растворимое в воде. Сильное основание. Однако по растворимости и силе LiОН уступает гидроксидам остальных s-элементов I группы. При накаливании LiОН (в отличие от ЭОH других щелочных металлов) разлагается:
Гидроксид LiОН — бесцветное очень гигроскопическое вещество, растворимое в воде. Сильное основание. Однако по растворимости и силе LiОН уступает гидроксидам остальных s-элементов I группы. При накаливании LiОН (в отличие от ЭОH других щелочных металлов) разлагается:
LiОН получают электролизом водных растворов LiСl. Применяется как электролит в аккумуляторах.
В отличие от Ве (II) аквокомплексы Li (I) менее устойчивы. В имеющихся кристаллогидратах лития отдельные аквоионы не обнаружены.
В ряде кристаллогидратов молекулы воды участвуют в образовании мостиковых связей. Так, в LiОН×Н2О (решетка моноклинная) Li окружен четырьмя атомами кислорода (два от ОН-групп и два других от молекул Н2О), образующими искаженный тетраэдр. Тетраэдры попарно соединены общими ребрами (за. счет атомов кислорода ОН-групп). Соседние пары тетраэдров связаны общими вершинами (через атомы кислорода молекул Н2О) и образуют бесконечную цепь состава LiОН×Н2О:
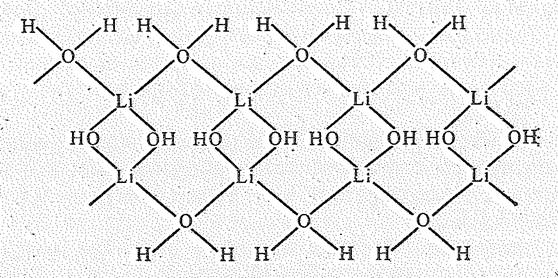
Цепи связаны друг с другом за счет водородной связи.
В кристалле LiСlО4×3Н2О каждый ион Li находится в центре октаэдра из молекул H2О; но каждая молекула Н2О принадлежит двум таким октаэдрам, образуя гексагональные столбики состава Li2(ОН2)6]2+, между которыми помещаются ионы СlО4-.
При взаимодействии (совместной кристаллизации или сплавлении) солей лития с однотипными соединениями других щелочных металлов образуются эвтектические смеси, например LiNО3 – КNО3 (T пл. 132 °С), LiNO3 — NаNO3 – KNO3 (Tпл. 120 °С), LiСl — КСl (Tпл. 350 °С) и др. Значительно реже образуются двойные соединения, например М1+LiSО4, Nа3Li(SО4)2×6Н2O, и твердые растворы.
Расплавы солей и их смесей составляют интересный и важный класс не- водных растворителей. В расплавленных солях растворяется большинство металлов. Эти растворы имеют интенсивную окраску и являются очень сильными восстановителями. В них растворенные металлы находятся либо в атомарном состоянии, либо в виде сольватированных ионов необычно низкой степени окисления (Аl+, Са+, Ве+). Растворение металлов в расплавленных солях имеет значение для многих электрометаллургических и металлотермических процессов, для рафинирования металлов, проведения различных синтезов.
|
|
|
Соединения, растворяясь в расплавленных солях, ионизируются, образуя сольватированные ноны. Например, при растворении СоСl в расплавленной эвтектике LiNО3—КNО3 образуется сольватированный ион [Со(NО3)6]4-, а при добавлении к этому раствору КСl получается ион [СоСl4]2-. В расплавленных солях могут протекать реакции как без изменения, так и с изменением степени окисления элементов.
Ряд минералов и искусственных соединений лития (алюминат, титанат, карбонат, силикат, молибдат и др.) применяется в производстве эмалей, специальных стекол, пропускающих ультрафиолетовые лучи, и др. Литий образует металлорганические соединения, что определяет его значение в современном органическом синтезе.
Натрий один из наиболее распространенных элементов на Земле (2,4 мол. доли, %). Он обнаружен в атмосфере Солнца и в межзвездном пространстве. Важнейшие минералы натрия: NаСl (каменная соль, галит), Na2SO4×10Н2О (мирабилит, глауберова соль), Nа3АlF6 (криолит), Nа3В4О7×10Н2O (бура) и др. В сочетании с другими элементами он входит в состав многих природных силикатов и алюмосиликатов. Огромное количество солей натрия находится в гидросфере (около 1,5×1016 т).
Соединения натрия содержатся в растительных и животных организмах, в последнем случае главным образом в виде NаСl. В крови человека ионы Nа+ составляют 0,32 %, в костях 0,6, в мышечной ткани - 0,6—1,5 %.
Простое вещество. В виде простого вещества натрий легкий (пл. 0,97 г/см3), мягкий серебристо-белый металл со сравнительно невысокими тёмпературами плавления (97,8°С) и кипения (883°С).
По химическим свойствам это активнейший металл. На воздухе тотчас окисляется, образуя рыхлые продукты окисления. При обычной температуре самовоспламеняется в атмосфере фтора и хлора. При небольшом подогревании энергично взаимодействует с жидким бромом, серой, иодом, водородом и др.
С многими металлами натрий образует интерметаллические соединения. Например, с оловом он дает ряд соединений: NаSn6, NаSn4, NaSn3, NаSn2, NаSn, Nа2Sn, Nа3Sn и др. С некоторыми металлами дает твердые растворы. Эвтектический сплав 24 % Nа и 76 % К в обычных условиях представляет собой жидкость (т. пл. - 12,6°С).
|
|
|
Натрий используется в металлотермии. Металлический натрий и его жидкий сплав с калием используется в органическом синтезе. Как восстановитель часто применяется амальгама натрия. Натрий используется также в качестве теплоносителя в ядерных энергетических установках, в клапанах авиационных двигателей, в химических производствах где требуется равномерный обогрев в пределах 450—650°С.
Натрий получают электролизом расплавленного NаСl и реже NаОН. При производстве натрия из NаСl (T пл. 800°С) температуру плавления электролита снижают (до 575—585°С) добавкой КСl, СаС2, NаF или других солей. Натрий хранят в запаянных сосудах или под керосином.
Соединения натрия (I). Для натрия (I) наиболее характерны ионные соединения. Его соединения имеют кристаллическое строение, отличаются большей или меньшей тугоплавкостью, в расплавленном состоянии являются электролитами, хорошо растворяются в воде. Труднорастворимы немногочисленные производные со сложными анионами, например гексагидроксостибат (V) Nа[Sb(ОН)6]. Сравнительно мало растворим (в отличие от карбоната) его гидрокарбонат.
Поскольку поляризующее действие иона Na+ незначительно, комплексные соединения для натрия нехарактерны. Даже аквокомплексы малоустойчивы. Поэтому большинство его солей кристаллогидратов не образуют. Относительно устойчивые кристаллогидраты типа Nа2SО4×10Н2О, Nа2СО3×10Н2О являются тектогидратами [1].
 Для натрия образование перекисных соединений более характерно, чем для лития. Так, взаимодействуя с кислородом, он (в отличие от лития) образует не оксид, а пероксид:
Для натрия образование перекисных соединений более характерно, чем для лития. Так, взаимодействуя с кислородом, он (в отличие от лития) образует не оксид, а пероксид:
Оксид же натрия Nа2О получают косвенным путем восстанавливая Nа2О2 металлическим натрием. Известны также малостойкие озонид NаО3 и надпероксид натрия NаО3. При сплавлении натрия с серой образуются персульфиды типа Nа2S2, Nа2S3, Nа2S4 и Nа2S5.
Из соединений натрия важное значение в технике имеют его хлорид, гидроксид, карбонаты и многочисленные другие производные.
Хлорид натрия встречается в природе в огромных месторождениях. Он является основой для целого ряда важнейших производств таких, как производство натрия, едкого натра, соды, хлора и др. Гидроксиднатрия (едкий натр, каустическая сода) в громадных количествах потребляется самыми разнообразными отраслями промышленности, главные из которых — производство мыл, красок, целлюлозы и др. Получают NаОН либо электролизом водных растворов NаСl, либо химическими методами.
Из химических методов наиболее распространен известковый способ производства NаОН. В основе этого способа лежит реакция взаимодействия раствора соды с гашеной известью:
Na2CO3 + Ca(OH)2 «2NaOH + CaCO3
Равновесие реакции смещено в сторону образования NaOH вследствие плохой растворимости СаСО3. Обработанная таким образом сода становится едкой (по-гречески каустической), поэтому-то получаемый таким путем гидроксид натрия и называется каустической содой. Потребляют карбонаты натрия многие отрасли промышленности: химическая, мыловаренная, бумажная, текстильная, пищевая и др. Карбонаты натрия вырабатываются или в виде Nа2СO3 (кальцинированная сода), или в виде кристаллогидрата Nа2СО3×10H2O (кристаллическая сода), или в виде гидрокарбоната NаНСО3 (питьевая сода).
Сода чаще всего производится по аммиачно-хлоридному методу, основанному на реакции
NaCl + NH4HCO3 «NaHCO3 + NH4Cl
равновесие которой смещается в сторону образования гидрокарбоната натрия ввиду его сравнительно малой растворимости.
Соду Nа2СО3 можно получить также восстановлением сульфата натрия углем в присутствии карбоната кальция:
Na2SO4 (т) + C (т) + СaCO3 (т) «CaS (т) + Na2CO3 (т) + 2CO2 (г)
DН = 502 кДж/моль, DS = 370 Дж/моль×град.
Поскольку эта реакция эндотермична, но протекает с увеличением энтропии системы, для ее осуществления необходимо нагревание.
Элементы подгруппы калия — калий К, рубидий Rb, цезий Сs и франций Fr — наиболее типичныe металлические элементы — катионогены. При этом с повышением порядкового номера этот признак у элементов усиливается. для них наиболее характерны соединения с преимущественно ионным типом связи, Вследствие незначительного поляризующего действия ионов (малый заряд, устойчивость электронной структуры, большие размеры), комплексообразование с неорганическими лигандами для К, Rb, Сs, Fr нехарактерно, даже кристаллогидраты для них почти не известны.
Наиболее важными минералами калия являются: сильвин КСl, сильвинит NаСl×КСl, карналлит КСl×МgСl2×6Н2O, каинит КСl×МgSО4×3Н2O.
Рубидий и цезий содержатся в минералах калия. Франций радиоактивен, стабильных изотопов не имеет. Он открыт в 1939 г. в продуктах радиоактивного распада урана (4×10-28 г на 1 г природного урана), Его получают искусственно. Наиболее долгоживущий изотоп 212Fr (Т1/2 = 20 мин) образуется при облучении урана протонами:
238U (р, 6р2In)212Fr
Вследствие малого периода полураспада изотопов сколько-нибудь заметных количеств франция накопить не удается, поэтому его свойства изучены недостаточно.
Простые вещества. В виде простых веществ калий и его аналоги блестящие серебристо-белые (за исключением золотисто-желтого цезия) металлы с объемно-центрированной кристаллической решеткой (как Li и Nа). Основные физические константы этих металлов (и для сравнения лития и натрия) приведены ниже. И как видно из приведенных данных, плотность К, Rb и Сs невелика (калий, подобно Li и Nа, даже легче воды), температуры плавления и кипения невысокие. Эти металлы очень мягки и легко режутся ножом.
 Существенно, что от лития к натрию и далее к калию значения большинства констант меняются довольно резко.
Существенно, что от лития к натрию и далее к калию значения большинства констант меняются довольно резко.
Калий и его аналоги — исключительно реакционноспособные металлы. На воздухе калий тотчас окисляется, образуя рыхлые продукты взаимодействия; цезий и рубидий самовоспламеняются.
В атмосфере фтора и хлора эти металлы самовоспламеняются при обычных условиях. Взаимодействие их с жидким бромом сопровождается сильным взрывом. При нагревании они легко взаимодействуют с серой, водородом и другими неметаллами. С металлами образуют большей частью интерметаллические соединения.
Калий и его аналоги располагаются в самом начале ряда напряжений. Взаимодействие калия с водой сопровождается самовоспламенением выделяющегося водорода, а взаимодействие рубидия и цезия даже взрывом.
Рассматриваемые металлы при нагревании и освещении сравнительно легко теряют электроны. Эта способность делает их ценным материалом для изготовления фотоэлементов.
В технике калий получают натрийтермическим методом из расплавленного гидроксида или хлорида, рубидий и цезий — методами металлотермии и термическим разложением соединений. Калий и его аналоги хранят в запаянных сосудах. Калий, кроме того, можно сохранять в керосине.
Соединения калия (I), рубидия (I), цезия (I). Производные калия и его аналогов являются преимущественно солями и солеподобными соединениями. По составу, кристаллическому строению, растворимости и характеру солъволиза их соединения проявляют большое сходство с однотипными соединениями натрия.
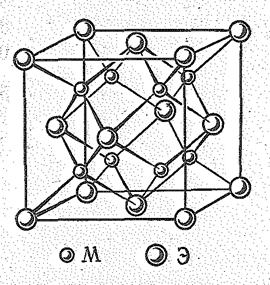
Кристаллы соединений щелочных металлов характеризуются высокими координационными числами. Так, гидриды ЭН имеют структуру типа NаСl, галогениды ЭНаl структуру типа NаСl и СsСl. Оксиды Э2O, сульфиды Э2S, селениды Э2Sе и теллуриды Э2Те калия и рубидия (а также Li м Nа) имеют структуру типа антифлюорита (рис. 1), т. е. тетраэдро-кубическую координацию атомов.
| 
|
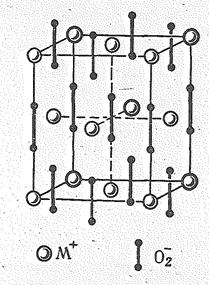
| Рис. 1. Кристаллическая решетка М2О (тип антифлюорит). | Рис. 2. Кристаллическая решетка надпероксидов типа МО2. |
В соответствии с усилением химической активности в ряду К — Rb — Сs возрастает тенденция к образованию перекисных соединений. Так, в отличие от лития, дающего при сгорании на воздухе оксид, и натрия, переходящего в тех же условиях в пероксид, К, Rb и Сs при сгорании образуют надпероксиды ЭО2 (рис. 2). Косвенным путем можно получить также пероксиды Э2О2 которые менее устойчивы, чем Na2O2.
Пероксиды и надпероксиды — сильные окислители, Водой, а тем более разбавленными кислотами они легко разлагаются:
2КО2 + 2Н+ = 2К+ + Н2О2 + О2
Еще более сильными окислителями являются озониды ЭО3. Они образуются при действии озона на твердые гидроксиды:
4КОН + 4О3 = 4КО3 + О2 + 2Н2О
При хранении озониды постепенно разлагаются уже в обычных условиях:
2КО3 = 2КО2 + О2, DGo298 = —86 кДж/моль,
а в воде бурно вьтделяя кислород:
4КО3 + 2Н2О = 4К+ + 4ОН- + 5О2
Персульфиды (полисульфиды) калия и его аналогов могут быть получены кипячением сульфидов с избытком серы (или при сплавлении сухих сульфидов с серой). Устойчивость полисульфидов в ряду К — Rb — Сs также увеличивается. Для калия и его аналогов выделены и изучены все члены ряда Э2Sn, вплоть до n = 6 (тогда как для Nа до n =5, а для Li до n =2).
Оксиды (белый К2O, желтый Rb2O и оранжевый Сs2O), подобно Na2Oочень реакционноспособные вещества, энергично взаимодействуют с водой, образуя гидроксиды. 06 усилении химической активности в ряду Li2O — Nа2O — К2O — Rb2O —Сs2O можно судить по изменению значений энергии Гиббса для реакции
1/2Э2O (к) + 1/2Н2O (г) = ЭОH (к)
которая для LiОН составляет —46,8 кДж/моль, для NаOН — 77,6, для КОН — 102,4, для RbOН —104,5, для СsOН —104,5 кДж/моль. Этот же пример свидетельствует о значительном изменении свойств при переходе от Li к Nа и от Nа к К.
Э2O можно получить восстановлением надпероксидов ЭO2 металлами:
КО2 + 3К = 2К2О
Гидроксиды ЭОН — бесцветные очень гигроскопические вещества. При накаливании они, подобно NаОН, возгоняются без разложения. Хорошо растворяются в воде, при этом выделяется значительное количество тепла. В водных растворах ЭОH, подобно NаOН, ионизированы почти нацело и являются самыми сильными основаниями — щелочами — КОН, RbOН, СsОН. Из них наибольшее значение в технике имеет гидроксид калия (едкое кали) КОН. Его получают электролизом водного раствора КСl.
В противоположность аналогичным соединениям Li+ и Nа+ такие соединения элементов подгруппы калия, как их оксохлораты (VII) ЭСlО4, хлороплатинаты (IV) Э2РtСl6, нитритокобальтаты (III) Э3[Со(NO2)6] и некоторые другие, труднорастворимы.
Из многочисленных производных элементов подгруппы калия наибольшее значение имеют производные калия. Около 90% добываемых солей калия потребляется как удобрения (в виде КNО3, КСl, К2SО4 и др.). Соединения калия применяются также в производстве стекла, мыла и др. Соединения калия, рубидия, цезия и франция используются в медицине.
[1] Своеобразные упорядоченные твердые растворы внедрения соль-лед.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1528; Нарушение авторских прав?; Мы поможем в написании вашей работы!