
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Величины, необходимые для расчетов реакторов и балансов
Концентрация вещества – отношение количества вещества в молях к объему реактора, в котором равномерно распределено это вещество.
Для периодических процессов:
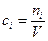
Для непрерывных процессов:

При определении концентрации могут встретиться два случая:
I. Когда объем и объемный поток остаются неизменными во времени. Это наблюдается в случае жидкофазных реакций и в случае газофазных реакций при постоянном давлении, температуре и неизменности числа молей компонентов. Тогда во всех, выведенных формулах материального баланса, вместо ni или Fi можно использовать концентрации. Если имеется газовая смесь, то вместо концентраций часто используют парциальное давление.

Газы смешиваются друг с другом в любых соотношениях, и каждый газ, входящий в состав смеси, характеризуется своим парциальным давлением. Парциальное давление – давление, которое оказывало бы имеющееся в смеси количество газа, если бы он занимал весь объем, который занимает смесь при той же температуре. Для газов выгоднее работать с парциальными давлениями!
Закон Дальтона гласит: давление смеси газов, химически не взаимодействующих друг с другом, равно сумме их парциальных давлений.
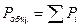
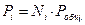

Часто стоит вопрос, о приводе газов к нормальным условиям. Нормальные условия: давление – 101,325 кПа = 1 атм. = 760 мм. рт. ст.; температура – 273 К = 0 оС.
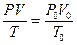
Все газовые законы даются только для идеальных газов, в них отсутствует межмолекулярное взаимодействие!
II. Реакции с изменением объема. Например, процесс поглощения газа жидкостью или разложение жидкости на газообразные продукты.
 ,
,
где V 0 – начальный объем;
V – текущий объем реакционной системы;
ξ – коэффициент изменения объема;
Z – функция, от которой зависит изменение объема (степень конверсии или изменение числа молей газа).
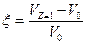 .
.
Коэффициент изменение объема положительный, если объем увеличивается, и отрицательный, если объем системы уменьшается. Тогда, текущая концентрация:
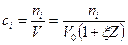 .
.
Коэффициент изменения объема часто записывается через стехиометрические коэффициенты:
A → B + Z
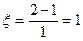 ;
;
A + Y → B

Если в реакции присутствует инертные растворитель и число его молей равно β 0, то при расчете коэффициента изменения объема необходимо его учитывать:
A → B + Z
 ;
;
A + Y → B

Y взято в избытке. Необходимо найти ξ. Βy – количество вещества Y.
A + Y → B
| A | Y | B | |
| τ = 0 | Βy | ||
| τ = τр | Βy – 1 | ||
| N |

|
Дата добавления: 2014-01-07; Просмотров: 400; Нарушение авторских прав?; Мы поможем в написании вашей работы!