
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие органических реакций
|
|
|
|
В случае равновесной реакции:
A + B  C + D
C + D
Свойства равновесия:
1. Динамичность, то есть, процесс во времени не останавливается, выравниваются лишь скорости прямой и обратной реакций.
2. Неизменность равновесного состава при постоянных внешних условиях.
3. Подвижность. То есть, самопроизвольное восстановление состояния равновесия после снятия внешнего воздействия, которое вызвало отклонение системы от состояния равновесия.
4. В момент равновесия 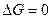 .
.
Для расчета количеств равновесного состава систем будем пользоваться законом действующих масс:



rпр. = rобр.


Если взяты не жидкости, а, например, газы, то константу равновесия находят как:
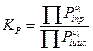
В случае если растворы обладают высокой ионной силой, вместо концентрации следует использовать активность.
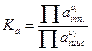
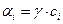
γ – коэффициент активности.
Коэффициент активности показывает отклонение от идеальности раствора.

Закон Вант-Гоффа.
Связывает между собой термодинамические функции и константу равновесия:
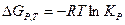
Для расчета энтальпии и энтропии, а также  при различных температурах применяются законы Кирхгофа:
при различных температурах применяются законы Кирхгофа:
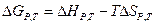

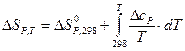

Эти уравнения можно решать напрямую, для этого обычно используется метод Темкина-Шварцмана:
 ,
,
где a, b, c – постоянные экспериментальные коэффициенты.
Но обычно ограничиваются тремя слагаемыми:
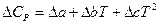
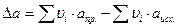
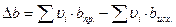

 ,
,
где M 0, M 1, M 2 – интегралы Темкина-Шварцмана. Определяются из таблиц, либо по формулам.
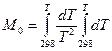


|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 724; Нарушение авторских прав?; Мы поможем в написании вашей работы!