
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет констант равновесия в идеальных растворах
|
|
|
|
Расчет равновесного состава смеси в случае жидкофазной реакции.
Идеальными называются растворы, в которых отсутствует межмолекулярное взаимодействие и они подчиняются законам Рауля и Генри.
Закон Рауля: относительное понижение парциального давление пара растворителя над разбавленным раствором не электролита равно мольной доле растворенного вещества.
 ,
,
где  - давление насыщенного пара растворителя над чистым растворителем;
- давление насыщенного пара растворителя над чистым растворителем;
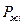 - давление насыщенного пара над раствором.
- давление насыщенного пара над раствором.

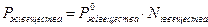
Закон Генри: в предельно разбавленных растворах парциальное давление пара над раствором пропорционально растворимости компонента:
 ,
,
где K – постоянная или константа Генри.
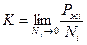
Рассмотрим раствор как идеальную систему, не выделяя растворитель и растворенное вещество. Тогда:
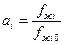 .
.
Для жидкости стандартным является такое состояние, когда этот компонент находится в виде чистой жидкости при стандартных условиях.
Для идеальных растворов фугитивность компонента практически не отличается от парциального давления и пропорционально мольной доле компонента в растворе.
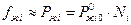
Поэтому:

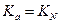 .
.
Поэтому в жидкой фазе константа равновесия может быть выражена и легко посчитана через KN.

Это уравнение справедливо для растворов углеводородов, их галоген производных, а в меньшей степени для простых эфиров, сульфидов, кетонов, альдегидов и меркаптанов.
Существует способ с использованием справочной литературы, поскольку:
 .
.
 ,
,
 .
.
Либо при отсутствии справочных данных:


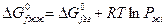
Ограничения, которые накладываются на последний метод. Это метод справедлив только тогда, когда растворенные вещества находятся в сольватированном виде и не оказывают влияние друг на друга.
|
|
|
Соотношение между KP и KN.
KN – константа равновесия в жидкой фазе.


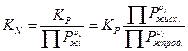
Более простым путем для расчета KN является определение KP, умноженное на отношение произведения равновесных давлений паров над чистыми жидкими реагентами к произведению равновесных давлений паров над чистыми жидкими продуктами.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 657; Нарушение авторских прав?; Мы поможем в написании вашей работы!