
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорости реакций и их взаимосвязь
|
|
|
|
Скорости превращения веществ
Для периодических реакторов:

i – компонент, вещество.
Для непрерывных реакторов:
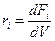 ,
,
ri – скорость превращения вещества.
Из уравнений материального баланса:
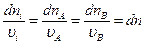 ;
;
.
После преобразований получается скорость реакции:
 .
.
В отличие от скорости превращения, скорость реакции инвариантна относительно участков реакции и всегда положительна.
 .
.
Скорость превращения реагентов отрицательна; продуктов положительна.
Если реакция сложная, то для каждой простой j реакции можно записать:
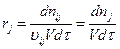 ;
;
 .
.
При решении задач необходимо учитывать:



Изменение мольного количества компонентов складывается из изменений по всем реакциям.
Математически скорость реакции – это производная от полноты реакции, так как в сложных реакциях вещество может образовываться и расходоваться по j простым реакциям, следовательно, общая скорость превращения связана со скоростью соответствующих реакций:
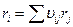
Базис – число независимых уравнений.
Для ОВР:
У = В – Э
Без изменения степеней окисления:
У = В – Э + 1,
где У – число уравнений в базисной системе;
В – число веществ-участников химического превращения;
Э – число химических элементов, из которых состоят вещества.
Схема превращения и способы ее подтверждения
Необходимым условием правильно составленной схемы превращение является: при суммировании всех стадий все промежуточные частицы и комплексы должны сокращаться, давая в итоге стехиометрическое уравнение (базис реакции).
Базис реакции – кинетическое описание процесса, как системы дифференциальных уравнений для скоростей превращения ключевых веществ для совокупности элементарных реакций.
|
|
|
Для построения кинетических уравнений по сложному механизму, часто используют метод маршрутов реакций.
Маршрут реакции – совокупность элементарных стадий с их стехиометрическими числами, необходимыми чтобы при математических операциях с этими стадиями в результате получалось единственное стехиометрическое уравнение реакции.
Пример:
А + B = C + 2E
Элементарные стадии:
A = D + 2K
D + B = C
υK = υE
υK = υE = 1
Если:
2K = 2E
+
D + B = C
A = D + 2K
2K + D + B + A = 2E + C + D + 2K
A + B = 2E + C
Стехиометрическое число:
γE = γK = 2
Для реакций, имеющих сложный механизм, большое значение имеет метод маршрутов развитый Хориути-Тёмкиным.
Метод состоит в том, что число независимых маршрутов, описывающих механизм реакции, называется базисом маршрутов и равняется разности стехиометрически независимых стадий базиса реакции и количества промежуточных комплексов или частиц.
Метод маршрутов позволяет установить стехиометрическое уравнение реакции с точки зрения стехиометрии.
А = В или 2А = 2В
С точки зрения механизма реакции, термодинамических и кинетических расчетов, необходимо учитывать маршрут.
Если:
А = Х последовательно Х = В,
то уравнение реакции:
А = В.
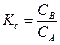 .
.
Если:
А = Х + В;
Х + А = В,
то
2А = 2В;
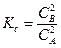 .
.
Во-первых, маршруты реакций могут состоять из линейной последовательности стадий, тогда при построении кинетических уравнений и расчете констант устраняются константы всех промежуточных частиц.
Во-вторых, маршруты реакций могут состоять из замкнутых стадий, например каталитические или цепные. Обычно в таких реакциях концентрация катализатора остается неизвестной и для ее нахождения требуется дополнительные условия: уравнения баланса по различным формам катализатора.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 977; Нарушение авторских прав?; Мы поможем в написании вашей работы!