
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Часть 1 аналитическая химия
|
|
|
|
Лекция 4 Кислотно-основные индикаторы. Титрование в неводных средах.
Лекция 2Равновесия в гомогенной и гетерогенной системах. Гравиметрический
метод анализа… ………………………………………………………………………….
Лекция 3 Титриметрический (объёмный) метод анализа………………………….
Теория кислот и оснований………………………………………………………………
Лекция 5 Окислительно-восстановительные методы (редоксиметрия)………………
Лекция 6 Метод комплексообразования (комплексометрия)………………………...
Лекция 7 Методы осадительного титрования………………………………………..
Лекция 8 Статическая обработка результатов анализа………………………………...
ВВЕДЕНИЕ
Аналитическая химия, являясь одной из общеобразовательных дисциплин, закладывает теоретические основы изучения специальных дисциплин, важнейших в системе образования специалистов: инженеров-химиков и товароведов-экспертов.
Рациональное управление производственными процессами в химической, металлургической и машиностроительной отраслях невозможно без знания качественного и количественного состава сырья, промежуточной и готовой продукции. Инженер химик-технолог должен обладать достаточными знаниями в этой области химии, так как они требуются при проектировании, изготовлении и эксплуатации машин и аппаратов. Знание курса аналитической химии и физико-химических методов анализа необходимо также для успешного изучения других специальных дисциплин.
Товароведы-эксперты должны не только знать ассортимент товаров и поддерживать его на определённом уровне, создавая условия для сохранения качества товара, но и должны уметь проводить экспертизу товара при приёмке его на реализацию. Умение определять физико-химические свойства товара необходимо для установления закономерностей, связывающих его физические и химические свойства с химическим составом, что позволяет проводить идентификацию исследуемого объекта, а также даёт возможность контролировать его качественный состав.
|
|
|
Курс аналитической химии дает теоретическую и практическую подготовку студентов, предполагает получение ими знаний и навыков, необходимых для решения задач по установке качественного, количественного и структурного состава различных объектов исследования. Аналитическая химия как наука в последнее время претерпела существенные изменения. Значительно расширился круг объектов исследования, среди которых особая роль принадлежит многочисленным органическим соединениям. Развитие биологии, биохимии, химии природных и синтетических биологически активных веществ потребовало совершенствования методов разделения и анализа сложных смесей. Все более актуальным становится исследование структуры и межмолекулярной взаимосвязи веществ.
Цель преподавания дисциплины заключается в обучении студентов теоретическим основам аналитической химии и приобретению ими навыков практического применения методов качественного и количественного анализа для определения соединений неорганической и органической природы, активному использованию этих методов применительно к неорганическим и органическим объектам, правильной оценке полученных результатов. Изучение курса "Аналитическая химия" основывается на базе курса "Неорганическая химия". Предполагается, что студент умеет выполнять частные реакции открытия катионов и анионов, может рассчитать концентрации Н+, ОН- - ионов, имеет представление о гидролизе солей различного типа, о комплексных соединениях, о малорастворимых соединениях и может на основании ПР вычислить концентрации ионов в растворе (и наоборот); умеет уравнивать окислительно-восстановительные реакции.
В рамках изучаемого курса специалисту необходимо освоить:
|
|
|
-основные законы, применяемые в количественном анализе;
-основные формулы для расчетов, применяемые в количественном анализе;
-принципиальные основы выбора методов анализа неизвестных веществ. Специалист должен выработать навыки самостоятельного проведения качественных и количественных экспериментов и овладеть техникой основных количественных расчетов.
-правильно выполнять расчеты результатов анализа и оценивать их с помощью мето-дов математической обработки.
В лекционный курс включены три основные раздела - введение и теоретические основы аналитической химии: качественный и количественный химический анализ.
Лекция 1 Введение в аналитическую химию. Качественный анализ.
1. 1 Предмет, задачи аналитической химии
Аналитическая химия – не просто дисциплина, накапливающая и систематизирующая знания; эта наука имеет огромное практическое значение в жизни общества, она создает средства для химического анализа и обеспечивает его осуществление – в этом ее главное предназначение. Без эффективного химического анализа невозможно функционирование ведущих отраслей народного хозяйства, систем охраны природы и здоровья населения, оборонного комплекса, невозможно развитие многих смежных областей знания.

Аналитическая химия позволяет:
1) выяснить природу вещества, т.е. установить является ли вещество органического или неорганического происхождения;
2) установить в какой форме находятся элементы данного вещества: - в виде простого вещества, оксида, соли.
3) определить содержание главного компонента и посторонних примесей;
4) установить формулу неизвестного вещества.
Таким образом, предметом аналитической химии являются развитие теории и практики разнообразных методов анализа. Задачами аналитической химии являются:
1) анализ природных веществ, технических материалов и окружающей среды;
2) развитие теории методов анализа;
3) усовершенствование существующих методов анализа;
4) разработка новых методов анализа;
|
|
|
5) обеспечение аналитического контроля производства в металлургии, биохимии, геохимии, биологии и медицине.
Аналитическая химия играет большую роль в производстве любых веществ: без анализа нет и синтеза.
В XXI веке аналитическая химия начала развиваться особенно бурными темпами. Это связанно с тем, что в химических лабораториях появились физические приборы. Регистрирующие устройства приборов (детекторы) способны были воспринимать такие сигналы, которые человек не способен оценивать по величине. Открылась возможность определять вещества, концентрация которых очень мала 10-12 грамм (60-е годы), а сейчас 10-16 грамм (нейтроноактивационный метод).
1. 2 Качественный и количественный анализ.
Анализ веществ делится на качественный и количественный.
При помощи качественного анализа находят из каких элементов, ионов, атомов и молекул состоит анализируемое вещество. Количественный анализ позволяет установить количественные соотношения составных частей данного соединения или смеси веществ. Качественный анализ всегда предшествует количественному.
Качественны й и количественны е методы в свою очередь делятся на химические, физические и физико-химические.
В основе химических методов лежат химические реакции, сопровождающиеся каким-либо внешним эффектом: изменением цвета, выделением газов, образованием осадков. Например, серу можно выделить, при её нагревании, при этом образуется двуокись серы, обладающая характерным запахом.
Физическими методами анализа называются методы, при помощи можно определять состав веществ, не прибегая к химическим реакциям. К физическим методам анализа относят методы, основанные на измерение оптических, электрических, магнитных, тепловых и других физических свойств анализируемых веществ.
К числу наиболее известных физических методов анализа относят:
1) спектральные методы анализа, основанные на исследовании спектров испускания или поглощения анализируемого вещества;
2) люминесцентный анализ основан на наблюдении люминесценции (свечении) анализируемого вещества вызываемой действием УФ -лучей;
|
|
|
3) рентгеноструктурный анализ, основанный на исследовании рентгеновских лучей;
4) масс-спектроскопический анализ, основанный на использовании специальных приборов масс-спектрометров;
5) методы основанные на измерении плотности.
Физические методы отличаются рядом преимуществ перед химическими методами и очень часто применяются в сочетании с ними.
Физико-химические методы основаны на изучении физических явлений, которые происходят при химических реакциях, сопровождающихся изменением цвета раствора, интенсивности окраски (калориметрия), электропроводности (кондуктометрия) и др.
В данном пособии рассматриваются методы качественного и количественного химического анализа.
1. 3 Методы качественного анализа
Целью качественного анализа является обнаружение элементов или ионов, входящих в состав вещества. Для решения этой задачи аналитическая химия использует химические реакции и физические свойства веществ. Из множества химических реакций для обнаружения элементов или ионов используются лишь те реакции, которые сопровождаются внешним эффектом (выделением газа, образованием осадка или окрашенного соединения).Такие реакции называются аналитическими. Реакции с внешними эффектами, характерными только для одного иона или соединения, называются специфическими. Как правило, химические реакции не специфичны и, в лучшем случае, селективны, т. е. дают внешний эффект, характерный для нескольких ионов, соединений или элементов.
Для проведения качественного химического анализа существуют различные способы:
а) Качественный анализ можно проводить «мокрым» и «сухим» путем Химический анализ в растворах называют анализом мокрым путем. Для растворения анализируемого вещества применяют дистиллированную воду, уксусную и минеральные кислоты, органические растворители.
В некоторых случаях вещества анализируют сухим путем, без перевода их в раствор. Обычно такой анализ сводится к испытанию способности вещества окрашивать бесцветное пламя в характерный цвет или придавать определенную окраску сплаву, полученному при нагревании анализируемого вещества с другим веществом. Для проведения испытания платиновую проволоку нагревают в пламени горелки и быстро вносят в сухое анализируемое вещество или его смесь с фосфатом Na или бурой. Вещество или смесь прилипает к проволоке, её опускают в HCl, образующаяся при этом хлористые соединения обладают большой летучестью и окрашивают бесцветное пламя в характерный для исследуемого элемента цвет.
б) Микрокристаллический метод анализа.
Этот метод анализа основан на обнаружении соединений тех или иных элементов при помощи реакций в результате которых образуются соединения, обладающие характерной формой кристаллов. Кристаллы характерной формы получают при работе с чистым веществом путем внесения капли раствора или кристалла реактива в каплю исследуемого вещества, помещенную на предметном стекле. Через некоторое время появляются кристаллы определенного цвета и формы, которые рассматривают в микроскоп.
в) Капельный анализ.
Большое значение в аналитической химии приобрел т.т. капельный анализ. При капельном анализе отдельные реакции на фарфоровых или стеклянных пластинках или на фильтровальной бумаге. При этом на пластинку или на бумагу наносят каплю испытуемого раствора и каплю реактива, вызывающего характерное цветное окрашивание или образование кристаллов. Этот метод анализа применим не всегда, тем не менее он служит хорошим средством исследования.
г) Бесстружковый метод анализа.
Этот метод используют для анализа черных, цветных и драгоценных металлов. Он позволяет сохранить целостный и внешний вид образцов. При бесстружковом методе анализа каплю растворителя металла наносят на поверхность образца. Образовавшийся раствор снимают с поверхности металла капилляром. Затем с полученным раствором проводят соответствующие реакции.
д) Макро-, микро-, полумикро- или ультромикрометоды.
В зависимости от количественного анализируемого вещества, объема раствора, используемого для анализа, от применяемой техники все методы делятся на макро-, микро-, полумикрометоды.
При выполнении анализа микрометодом для проведения реакции берут 1-2мл., содержащего не менее 0,1 г вещества и к используемому раствору добавляют не менее 1 мл. раствора реактива. Реакции проводят в пробирках.
При выполнении анализа микрометодом требуется в 100 раз меньший объем раствора анализируемой пробы или сухого вещества. Поэтому применяемые при микроскопическом методе анализа посуда, приборы и т.п. значительно отличается по своим размерам от применяемых в макроскопическом анализе.
Для анализа еще меньших количеств исследуемого вещества прибегают к ультрамикроскопическим методам. Для проведения анализа берут очень малые количества вещества 10-6 – 10-12 г и используют специальную аппаратуру. Промежуточное положение между макро- и микрометодом анализа занимает полумикроскопический метод, в этом методе требуется 0,01 г вещества.
1. 4 Понятие об аналитических реакциях.
Не всякая реакция может применяться как качественная аналитическая реакция, она должна отвечать следующим требованиям:
1) протекать очень быстро;
2) сопровождаться образованием характерного осадка, газа или появлением окрашивания;
3) быть необратимой;
4) быть специфической и отличатся высокой чувствительностью.
Для обнаружения ионов особое значение имеют специфические реакции. Специфические реакции – это такие реакции которые дают возможность в определенных условиях обнаружить одни ионы в присутствии других. При этом образуется характерный осадок, газ и др. Например, очень специфическая реакция йода с крахмалом (синее окрашивание).
Чувствительность реакции – характеризуется тем наименьшим количеством исходного вещества, которое может быть обнаружено данными реактивами в 1мм3 раствора (в капле). Чем меньше количество вещества, которое мы сможем обнаружить тем больше чувствительность реакции. Чувствительность можно выразить тремя показателями:
1) Открываемый минимум реакции – это минимальное количество вещества в исследуемом растворе, открываемое,тоесть определяемое данным реактивом в 1кмоле раствора.
2) Минимальная или предельная концентрация – показывает, при какой минимальной концентрации вещества в растворе данная реакция дает возможность еще открывать вещество из определенного объема. Объем выражается отношением, например, предельная концентрация  -ионов хлористоводородной кислотой 1:10000мл – это значит 1г
-ионов хлористоводородной кислотой 1:10000мл – это значит 1г  можно обнаружить в 10000мл раствора.
можно обнаружить в 10000мл раствора.
3) Предельное разбавление – величина обратная предельной концентрации. В предыдущем примере – 10000 мл. Таким образом, аналитическая реакция тем чувствительней, чем меньше открываемый минимум, чем меньше минимальная или предельная концентрация анализируемого вещества, чем больше предельное разбавление.
На чувствительность реакции влияют разнообразные факторы, поэтому большое значение имеют методы повышения чувствительности реакции.
Способы повышения чувствительности реакции.
Одним из самых эффективных способов повышения чувствительности являются следующие:
1) выпаривания раствора (т.е. повышение концентрации);
2) предварительное осаждение определяемого соединения из раствора;
3) маскировка посторонних ионов;
4) экстрагирование соединения органическими растворителями и др.
Маскировка мешающих ионов, применяется в том случае, когда одновременно с открываемым компонентом реактив взаимодействует с посторонними ионами, которые присутствуют в анализируемой смеси.
В качественном анализе различают общие и частные реакции. Общие реакции это такие, при которых реактив реагирует с несколькими ионами. Частными реакциями называют реакции, при которых различные реактивы образуют характерное соединение с одним ионом.
В качественном анализе различают реакции обнаружения, ионов и реакции отделения ионов. В реакция обнаружения используют специфические реакции (анализ сметаны) В реакциях отделения прибавляют реактив, который образует с одним ионом осадок, а с другим нет.
1. 5 Понятие о дробном и систематическом методах анализа.
Метод анализа, основанный на использовании дробных реакций, называют дробным анализом. Дробные реакции – это реакции, которые позволяют обнаруживать исходные ионы при условии устранения влияния посторонних ионов. Этот метод заключается в том, что отдельные небольшие пробы исследуемого раствора обрабатывают реактивами, устраняющие влияние посторонних ионов. Затем обнаруживают анализируемые ионы с помощью характерных реакций. В этом методе используют высокочувствительные избирательные реактивы, позволяющие обнаружить данный ион в присутствии других. Он дает возможность быстро обнаруживать ограниченное число ионов (от 1 до 5) содержащихся в смеси.
Дробный качественный анализ имеет много преимуществ перед другими аналитическими методами, но он позволяет определять не сложные смеси.
Полный анализ многокомпонентной смеси можно проводить значительно быстрее, если применить систематический метод анализа.
При выполнении систематического анализа соблюдается определенный порядок разделения и последующего обнаружения ионов. Поэтому для исследования берут одну большую пробу анализируемого раствора, затем ионы разделяют на группы. Для этого используют сходства или различия свойств ионов в отношении действия групповых реактивов. Группы ионов разделяют на подгруппы, а затем в пределах данной подгруппы обнаруживают отдельные ионы с помощью специфических реакций.
Таким образом, в основе систематического метода анализа лежит разделения катионов и анионов на группы. Разделение на группы и классификация ионов основана на различной растворимости их солей в воде. Единой классификацией катионов и анионов нет. Одни исследователи в качестве группового реактива используют сероводород и все катионы делят на 2 группы: ионы, осаждаемые сероводородом и ионы, не осаждаемые сероводородом. Ранние исследователи предлагают кислотно-основную классификацию. Существуют так же аммиачно-фосфатная, сульфидно-щелочная и другие.
Одной из наиболее удобной классификаций является кислотно-основная. В ней в качестве группового реактива являются кислоты и щелочи.
2 Кислотно-основная классификация катионов и анионов. Анализ неизвестного вещества
1. 6 Аналитическая классификация катионов
Согласно наиболее удобной в качественном анализе кислотно-основной классификации все катионы делятся на шесть групп по их отношению к серной и соляной кислотам, к едким щелочам и гидроокиси аммония (таблица 1).
Первая группа объединяет катионы NH4+, K+, Na+, которые не осаждаются ни минеральными кислотами, ни щелочами, т.е. не имеют группового реактива. Катионы второй группы Ag+, Hg+ и Pb2+ осаждаются соляной кислотой. Третью группу образуют катионы Ba2+, Sr2+ и Cа2+, которые осаждаются серной кислотой. Четвертой группой объединяются катионы Zn2+, Al3+, Сr3+, Sn4+, As3+ и As5+, не выпадающие при добавлении избытка щёлочи. Пятую группу составляют катионы Fe2+, Fe3+, Mg2+, Мn2+, Bi3+ , Sb3+, Sb5+ -все они осаждаются раствором щёлочи. Шестая группа катионов Hg2+, Cu2+, Сd2+, Со2+ и Ni2+ дает гидроокиси, растворимые в избытке 25-процентного раствора гидроокиси аммония с образованием растворимых аммиакатов.
Таблица 1
Разделение катионов на группы по кислотно- основной классификации
---------------------------------------------------------------------------------------
| Груп- па | Катионы | Групповой реагент | Получаемые соединения | Групповая характеристика | |
| K+, Na+, NH4+ | Нет | Хлориды, сульфаты и гидроокиси растворимы в воде | |||
| Ag+, Pb2+, Hg22+ | 2 н раствор HCl | Осадок AgCl и т.п. | Хлориды не растворимы в воде | ||
| Ba2+, Sr2+, Ca2+ | 2 н раствор H2SO4 | Осадок BaSO4 и т.п. | Сульфаты не растворимы в воде | ||
| Zn2+,As5+ Sn4+ , Al3+, Sn2+, Cr3+ | Избыток 4н раствора NaOH или KOH | Раствор ZnO22-, AlO2- и т.п. | Гидроокиси растворимы в избытке раствора NaOH и KOH | ||
| Mg2+, Mn2+, Bi3+, Fe2+, Fe3+, Sb3+, Sb5+, | Избыток 25% - ного раствора NH4OH | Mg(OH) 2, Mn(OH) 2 и т.п. | Гидроокиси не растворимы в избытке аммиака | ||
| Сu2+, Hg2+, Cd2+, Co2+, Ni2+ | Избыток 25% - ного раствора NH4OH | [Cu(NH3)4]3+, [Hg(NH3)4]3+ и т.п. | Аммиакаты растворимы в избытке раствора аммиака | ||
1. 7 Аналитическая классификация анионов
Деление анионов по группам основано но их отношении к различным реактивам; к растворам солей бария, стронция, кальция, магния, и др., к кислотам, окислителям, восстановителям. С этими реагентами анионы образуют малорастворимые осадки, газообразные вещества и характерно окрашенные соединения. Общепринятой аналитической классификацией анионов не существует. Одной из наиболее удобных классификаций является классификация, основанная на растворимости солей бария и серебра. Согласно этой классификации все анионы делятся на три группы (таблица 2).
Таблица 2
Классификация анионов
| Груп- па | Анионы | Групповой реактив | Характеристика группы |
| SO42-, SO32-, CO32-, PO43-, SiO32- | BaCl2 в нейтральном или слабощелочном растворе | Соли бария нерастворимы в воде | |
| Cl-, Br-, J-, S2- | AgNO3 в присутствии HNO3 | Соли серебра нерастворимы в воде и в разбавленной азотной кислоте | |
| NO3-, NO2-, CH3COO- | Группового реагента нет | Соли бария и серебра растворимы в воде |
1. 8 Анализ неизвестного вещества.
Анализ неизвестного вещества включает несколько стадий:
1) Подготовка вещества к анализу.
Способ подготовки зависит от характера этого вещества и целей анализа. Анализируемое вещество может быть твердым, жидким и газообразным. Твердые вещества измельчают в мельницах. Измельченный продукт просеивают через сито, а затем тщательно перемешивают и отбирают из него среднюю пробу.
Небольшую часть средней пробы твердого вещества переводят раствор и берут для анализа часть вещества. Если для анализа применяют готовый раствор, то его тщательно перемешивают.
2) Проведение предварительных испытаний.
Предварительные испытания дают возможность установить присутствие некоторых ионов, обнаружение которых затруднено при систематическом ходе анализа. Например, претерпевают изменение при подкислении, нагревании или увлекаются осадком при осаждении.
В зависимости от физического состояния вещества проводят различные предварительные испытания. К ним относятся:
а) нагревают в пламени горелки и наблюдают окраску пламени;
б) проверяют растворимость вещества в воде, кислотах и др. растворителях;
в) определяют рН раствора в воде;
г) проверяют отношение к окислителям и восстановителям;
д) определяют наличие таких катионов, как NH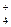 , Fe2+ и Fe3+
, Fe2+ и Fe3+
3) Проводят систематический анализ.
При систематическом анализе сначала проводят определение катионов. Для анализа на катионы анализируемый раствор разделяют на 5 пробирок и добавляют: 2н HCl, 2н H2SO4, NaOH, NH4OH NH4OH в избытке. По образованию осадков определяют, какие группы катионов входят в состав вещества. Далее разделяют все катионы на группы и анализируют каждую группу катионов с помощью специфических реакций.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2447; Нарушение авторских прав?; Мы поможем в написании вашей работы!