
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
II. По веществу-свидетелю
|
|
|
|
Пример: Ag+ + Cl- " AgCl $
Ag+ + CrO4" Ag2CrO4$ (ярко оранжевая окраска)
В колбу, где требуется определить ион хлора, добавляют небольшое количество соли K2CrO4 (свидетель). Затем из бюретки постепенно добавляют исследуемое вещество, при этом первыми в реакцию вступают ионы хлора и образуется белый осадок (AgCl), т. е.
ПР AgCl << ПР Ag2Cr O4.
Таким образом, лишняя капля нитрата серебра даст ярко оранжевую окраску, т. к. весь хлор уже прореагировал.
III. С помощью индикаторов: например, при реакции нейтрализации используют кислотно-щелочные индикаторы: лакмус, фенолфталеин, метил оранж – органические соединения изменяющие окраску при переходе от кислой к щелочной среде.
На область перехода окраски индикатора (положение и интервал) влияют все факторы, от которых зависит константа равновесия (ионная сила, температура, посторонние вещества, растворитель), а также индикатора.
3. 2 Классификация методов титриметрического анализа.
В зависимости от типа реакции, лежащей в основе метода, все объемные методы делятся на 4 вида.
- Кислотно-основные методы
В этих методах определяемое вещество – это кислота, основание или соль, имеющая кислотную или щелочную реакцию. Титрантами являются растворы сильных кислот или сильных оснований.
- Окислительно-восстановительныеметоды
В этих методах определяемое вещество – окислитель или восстановитель, а титрант – сильный восстановитель или окислитель
- Комплекснометрические методы
В этих методах определяемое вещество – это вещество, которое образует с титрантом прочный малодиссациирующий комплекс, а титрант – это вещество, образующее комплекс или с катионами или с анионами.
- Осадительное титрование
В этих методах определяемое вещество – это катионы или анионы, образующие осадки, а титранты – это вещества, образующие малорастворимые осадки с определенными катионами или анионами.
|
|
|
Кроме того, все объемные методы делятся на 2 вида – прямые и обратные.
Прямое титрование – это такое титрование, когда к определенному веществу приливают титрант до наступления конца титрования, т.е. до точки эквивалентности.
Обратное титрование (с избытком), используется при медленно протекающей реакции. Если скорость реакции мала, или не удается подобрать индикатор, или наблюдаются побочные эффекты, например потери определяемого вещества вследствие летучести, можно использовать прием обратного титрования: добавить к определяемому веществу заведомый избыток титранта Т1, довести реакцию до конца, а затем найти количество непрореагировавшего титранта титрованием его другим реагентом Т2 с концентрацией с2. очевидно, что на определяемое вещество затрачивается количество титранта Т1, равное разности сТ1VT1 – cT2VT2.
3. 3 Расчеты в объемном методе анализа
В объемном методе, как и в весовом рассчитывают или массу определяемого вещества, или его массовую долю.
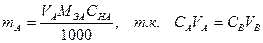 следовательно,
следовательно,
 ,
,
где V – объем титранта см3,
С – его нормальная концентрация,
MЭА – масса- эквивалента вещества, г.
 ,
,
где a – масса вещества (г), взятого для анализа.
Если для анализа взята лишь часть анализируемого раствора, то: 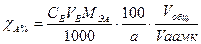
Часто в объемном методе рассчитывают титр одного вещества по другому, т.е. 
Тогда масса анализируемого вещества:
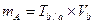 .
.
3. 4 Тема: Кислотно-основное титрование
В основе кислотно-основного титрования лежит реакция:
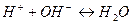 .
.
По этому методу можно проводить количественное определение оснований, титруя их кислотами с известной концентрацией, и кислот, титруя их основаниями с известной концентрацией. В этом случае соли определяют основания, метод иногда называют ацидиметрическим (acidium - кислота), а если кислоту – алкалиметрическим (alkali - щелочь). Основными стандартными в этом методе являются HCl или H2SO4 или NaOH и KOH. Эти вещества не отвечают требованиям, предъявляемым к стандартам, поэтому их концентрацию предварительно устанавливают по первичным стандартам. Т.к. невозможно приготовить раствор точно 0,100 М концентрации NaOH, HCl, т.к. они не очень чистые, взаимодействуют с атмосферой, гигроскопичны, поэтому перед началом титрования их концентрацию устанавливают по стандартам. Так, титр растворов оснований устанавливают по щавелевой или янтарной кислоте, а титр кислот – по соде или буре.
|
|
|
Стандартными для к/о титрования являются растворы сильных кислот и оснований т.к. заметное изменение pH в области точки эквивалентности наблюдается в том случае, если в реакции участвует сильная кислота или сильное основание.
Стандартной кислотой обычно служит соляная кислота, поскольку она довольно устойчива в течении длительного времени, реже HClO4, H2SO4.
Стандартные растворы кислот обычно готовят разбавлением концентрированной кислоты, а затем полученный раствор стандартизируют по первичному стандартному основанию.
Стандартизация – определение нормальности и Т раствора, титранта по первичным стандартам.
Для стандартизации кислот используют различные первичные стандарты:
 и другие.
и другие.
Первичными стандартами могут быть не все вещества, они должны быть устойчивы, негигроскопичны, должны хорошо очищаться от посторонних примесей.
Для приготовления растворов первичных стандартов с определенной концентрацией берут навеску первичного стандарта, помещают в мерную колбу, доводят объем раствора водой до метки. Затем отбирают часть раствора первичного стандарта и оттитровывают его титрантом, концентрацию которого необходимо определить.
Стандартным основанием обычно служат разбавленные растворы NaOH или KOH, т.е. растворы сильных оснований. Их также готовят из концентрированных щелочей путем разбавления.
Для стандартизации оснований также используют первичные стандарты. Но эти первичные стандарты – это вещества кислого характера.
3. 5 Кривые титрования в кислотно-основном титровании
|
|
|
По мере добавления к кислоте раствора щелочи (или наоборот) изменяется концентрация ионов H+ и OH-. Следовательно, pH раствора зависит от объема прилитого ститранта и его концентрации. Эту зависимость очень удобно выражать графически, откладывая по одной оси координат значение pH, а по другой – объем титранта.
Кривую, выражающую изменение значения pH титруемого раствора от объема титранта называют кривой титрования. Для графического построения удобно фиксировать изменение pH раствора, а не концентрацю ионов водорода.
pH
 V,см3
V,см3
Рисунок 1-Кривая титрования основания кислотой
Горизонтальную линию, проходящую через точку, соответствующую pH=7, называют линией нейтральности. Вертикальную линию, проходящую через точку эквивалентности, называют линией эквивалентности.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 879; Нарушение авторских прав?; Мы поможем в написании вашей работы!