
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 7 Методы осадительного титрования
|
|
|
|
7. 1 Общая характеристика метода и его классификация
Метод осадительного титрования основан на применении реакций осаждения, в результате которых образуются малорастворимые соединения. Метод осадительного титрования даёт возможность количественно определять анионы, осаждаемые катионами металлов и катионы, если титровать их анионами. Например, этот метод используют для определения таких катионов и анионов, как:
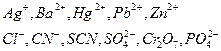
Различают следующие методы:
Аргентометрия – метод объемного анализа, основанный на применении стандартного раствора (титранта) ионов серебра. Различают три вида аргентометрии:
1)Титрование без индикатора (Гей-Люссак). В основе метода лежит реакция:
Ag++Hal ↔ AgHal↓
где Hal -ионы Cl-, J-, Br-.
Суть метода заключается в том, что титрование галогенов ведут до тех пор, пока последующая порция AgNO3 не вызывает образования новых количеств осадка. В этот момент в точке эквивалентности каждая лишняя капля AgNO3 вызывает коагуляцию осадка и раствор становится прозрачным. Этот метод называется методом просветления.
2)Титрование с индикатором
Метод основан на реакции, протекающей между Ag+ и Cl- в присутствии индикатора – К2CrO4. Титруют раствор, содержащий Cl- растором, содержащим Ag+ в присутствии K2CrO4. В точке эквивалентности лишняя капля Ag+ образует с ионами CrO4- красный осадок:
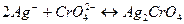
Красное окрашивание осадка свидетельствует о наступлении точки эквивалентности.
3)Титрование с адсорбционным индикатором.
Меркуриметрия и меркурометрия – методы, основанные на применении в качестве титрантов растворов солей двухвалентной (меркури-ион) и одновалентной (меркуро-ион) ртути. При меркуриметрическом определении ионов хлора происходит реакция:
|
|
|
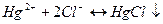
Точка эквивалентности определяется с помощью индикатора, образующего с избытка Hg2+ окрашенный комплекс. Этот метод применяется для определения Cl-, J-, Br-.
В основе меркурометрических определений лежит реакция:
Меркури- и меркурометрические методы имеют по сравнению с аргентометрическим методом преимущество: соли ртути менее дорогие по сравнению с серебром. Однако в то же время они более токсичны.
В связи с этим, метод осадительного титрования используют лишь тогда, когда другие химические методы не применимы. Например для определение ионов хлора, брома, серебра, бария, свинца, цинка проводят только этим методом. В таблице 1 приведены примеры осадительного титрования.
Таблица 1- Примеры осадительного титрования
| Определяемый компонент | Титрант | Индикатор |
| Br-, J-, SCN-, CO32-, CrO42-, CN-, C2O42-, PO43-, S2- | AgNO3 | K2CrO4 |
| Br-, J-, Cl-, SeO32- | -//- | Fe3+ |
| Zn2+ | K4[Fe(CN)6] | Адсорбционный |
| SO42- | Pb(NO3)2 | Адсорбционный |
| Ag+ | NH4SNC | Fe3+ |
| Cl-, Br- | Hg2(NO3)2 | Адсорбционный |
Не все реакции могут быть использованы для количественного определения катионов и анионов этим методом. Основными требованиями к реакциям, применяемым в методах осадительного титрования, являются следующие:
1) Выделяющиеся осадки должны по возможности обладать минимальной растворимостью. Для метода осадительного титрования применяются такие реакции, в результате которых образуется осадок, растворимость которого не превышает 10-5моль/л
2) Реакция должна идти быстро, а посторонние вещества в растворе не должны мешать реакции.
7. 2 Кривые титрования
Процесс осадительного титрования исследуют с помощью кривых титрования, которые позволяют определить пригодность метода для анализа и подобрать индикатор. Кривые титрования изображают зависимость концентрации вещества или титранта в титруемом растворе от объёма добавленного титранта. Для удобства концентрации изображают в виде функции «р»: рА= -lgCA (по аналогии с рН). На рисунке 1 приведены кривые титрования 0,1М растворов, содержащих ионы Cl-, J- раствором нитрата серебра той же концентрации и изменение концентрации ионов серебра в процессе титрования.
|
|
|

Рисунок 1- Кривые титрования ионов Cl-, J- (___) и Ag+ (---)
Таким образом, вблизи точки эквивалентности имеется резкий скачок pCl от 2 до 6 и pAg от 6 до 4. Нетрудно заметить, что величина скачка зависит от концентраций растворов. Разбавление растворов приводит к уменьшению скачка или к его исчезновению. На величину скачка титрования оказывает влияние и величина произведения растворимости осадка. Так, если титровать раствор KJ раствором AgNO3, образуется осадок AgJ (ПР = 10-16), скачок начинается при pJ 1 и заканчивается при pJ 10, т.е. занимает целых 6 единиц pJ. И, наоборот, чем больше величина произведения растворимости, тем скачок меньше (ПРAgCl= 10-10).
В связи с этим в титрометрическом анализе применяются только те реакции осаждения, при которых образующийся осадок практически нерастворим.
Метод осадительного титрования можно использовать для титрования не только индивидуальных веществ, но и для титрования смесей. Например, если в растворе имеется смесь Cl- и J- -ионов, то можно отдельно определить каждый анион. Кривая титрования будет приведена на рисунке 2.

Рисунок 2- Кривая титрования смеси ионов Cl- и J-.
Поскольку ПРAgJ = 10-16, а ПРAgCl = 10-10, то вначале оттитровываются иодид-ионы, а затем хлорид-ионы, так как сначала образуется соль AgJ, а затем, когда в растворе ионы иода уже отсутствуют, образуется соль AgCl. Для раздельного титрования ионов необходимо, чтобы произведение растворимости образующихся солей отличалось не менее, чем в 5 раз.
7. 3 Способы фиксирования точки эквивслентности в методе осадительного титрования
7. 3. 1 Безиндикаторные методы.
7. 3. 1. 1Метод равного помутнения (Гей-Люссака)
Если титровать раствор NaBr раствором AgNO3 то происходит реакции:
Br-+Ag+àAgBr
Осадок выпадает до тех пор, пока в растворе есть избыток брома. Поэтому если отбирать в конце титрования небольшие порции титруемого раствора в пробирки и добавлять к ним одну каплю разбавленного раствора AgNO3, можно увидеть – есть ли помутнение раствора. Если есть, титрование ведут дальше. Осадок же AgBr коагулирует, собирается на дне сосуда в виде крупных творожных частиц. Этот метод достаточно точен но кропотлив. Поэтому на практике пользуются другими методами.
|
|
|
7. 3. 1. 2 Титрование до точки просветления.
Он может быть применен в том случае, если малорастворимое соединение в процессе титрования находится в коллоидном состоянии. Так, например, при титровании J- раствором Ag+ до точки эквивалентности раствор мутный, а в точке эквивалентности, когда все ионы иода оттитрованы, происходит коагуляция частиц и осаждение их в виде крупных творожных хлопьев. Раствор при этом совершенно осветляется. Этот момент называется точкой просветления.
7. 3. 2 Методы с применением индикаторов
В осадительном титровании применяют три типа индикаторов: осадительные, металлохромные (комплексообразую Cl- и J- щие) и адсорбционные.
Осадительные индикаторы образуют с титрантом цветные осадки, при появлении которых титрование заканчивают. Например, применение K2CrO4 в качестве индикатора основано на способности CrO42- образовывать с Ag+ осадок Ag2CrO4 красно-коричневого цвета. Этот осадок начинает выпадать после того, как все ионы хлора будут связаны в осадок в виде AgCl. Причина заключается в различии величины растворимости хлорида (10-10) и хромата (10-5) серебра.Первым осаждается AgCl и только после того, как все ионы хлора будут связаны в осадок AgC, первая избыточная капля Ag+ дает красно-коричневое окрашивание раствора – это появляется Ag2CrO4. Другой метод основан на применении в качестве индикатора соли железа NH4Fe(SO4)2.12H2O при титровании растворов Ag+ раствором аммония NH4SCN.
Металлохромные индикаторы дают с титрантом цветной комплекс, образующийся около точки эквивалентности. Устойчивость этого комплекса должна быть меньше, чем устойчивость осадка, получающегося при осадительном титровании так как в противном случае комплекс будет образовываться раньше осадка.
Адсорбционные индикаторы представляют собой органические соединения, являющиеся слабыми кислотами, диссоциирующими согласно уравнению
|
|
|
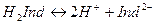
Молекулярная и ионные формы имеют разную окраску.
Анионы этих индикаторов, адсорбируясь на поверхности положительно заряженных коллоидных частиц, выпадающих в процессе титрования осадков, вызывают изменение цвета поверхности этих осадков. Если изменение цвета происходит вблизи точки эквивалентности, то можно использовать такие адсорбционные индикаторы для установления конца титрования.
Наиболее известными представителями этого класса органических соединений являются флуоресцин и эозин. Например, эозин представляет собой двунатриевую соль тетрабромфлуоресцина:
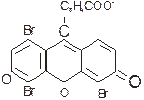 2Na+
2Na+
Действие этого индикатора основано на том, что, например, при титровании NaCl раствором AgNO3 до точки эквивалентности частицы осадка хлорида серебра адсорбируют на всей поверхности ионы хлора с образованием осадка белого цвета [AgCl]m . nCl-. Адсорбция ионов хлора наблюдается до тех пор, пока в растворе находятся свободные ионы Cl-. Поэтому, если в титруемый раствор добавить флуоресцина или эозина индикаторы не будут изменять окраски до тех пор, пока в растворе имеется избыток Cl--ионов. Это объясняется тем, что окрашенные анионы индикатора, несущие отрицательные заряды, не адсорбируются отрицательно заряженными коллоидными частицами осадка. В момент наступления точки эквивалентности при самом незначительном избытке AgNO3 осадок адсорбирует избыток Ag+ и вместе с ними NO3- ионы, при этом образуется осадок 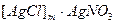 . Ионы NO3- не очень прочно удерживаются осадком так как не являются с ним одноименными, следовательно они легко замещаются на другие анионы, способные сильнее адсорбироваться осадком. Поэтому частицы осадка адсорбируют интенсивно окрашенные анионы индикатора и осадок окрашивается в тот цвет, который присущ молекулярной форме индикатора, что служит сигналом к прекращению дальнейшего титрования.
. Ионы NO3- не очень прочно удерживаются осадком так как не являются с ним одноименными, следовательно они легко замещаются на другие анионы, способные сильнее адсорбироваться осадком. Поэтому частицы осадка адсорбируют интенсивно окрашенные анионы индикатора и осадок окрашивается в тот цвет, который присущ молекулярной форме индикатора, что служит сигналом к прекращению дальнейшего титрования.
Лекция 8 Статическая обработка результатов анализа
1.1 Параметры, рассчитываемые при обработке результатов
В процессе анализа исследуемые пробы подвергаются химической обработке. Как правило, все химические реакции считаются равновесными и несмотря на то, что исследователи стараются выбрать реакции, практически смещенные в сторону продуктов, все же всегда имеют место явления, создающие случайные и систематические погрешности. Например, это могут быть различные солевые эффекты, явления соосаждения и другие, препятствующие полноте протекания реакций.
Существует два фактора, по которым аналитик судит о своих результатах:
1) воспроизводимость полученных результатов;
2) соответствие их содержанию в пробе (правильность результатов).
Воспроизводимость зависит от случайной погрешности, правильность - от систематической погрешности.
Погрешность титриметрического метода анализа определяется в основном погрешностью измерения объема и непосредственно зависит от величины капли, объем которой составляет в среднем 0,04 см3. При тщательном титровании можно снимать доли капли, например половину, тогда абсолютная погрешность измерения объема составит ± 0,02 см3, а относительная (при объеме, пошедшем на титрование, 20 см3):
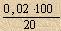 = 0,1 %
= 0,1 %
Поэтому, чтобы не снижать точность результатов, расчеты следует производить с ошибкой, не превышающей 0,1 %. Для этого все численные величины при расчетах (объемы раствора, молекулярные массы, эквиваленты, навески и т. д.) должны быть выражены четырьмя значащими цифрами. Например:
1) V = 19,53, а не 19,5 см3.
2) С(H2SO4) = 0,1010, а не 0,101 моль/дм3.
3) Т(H2SO4) = 0,004900, а не 0,0049 г/см3.
4) 1/2М(H2SO4) = 49,04, а не 49 г/моль.
Цель всех аналитических исследований - нахождение результата, наиболее близкого к истинному содержанию в пробе. Общую погрешность метода можно оценить только с привлечением методов математической статистики. Объективную оценку результата анализа получают путем математической обработки на основе теории ошибок. Как правило, ни одно единичное определение не дает истинного значения определяемой величины. Поэтому определение проводится несколько раз для нахождения наиболее вероятного значения определяемой величины. На практике при анализе всегда имеют дело с небольшим конечным числом измерений (n). Для учета влияния случайных погрешностей на результаты анализа рассчитывают следующие выборочные параметры: среднеарифметический результат определений, дисперсию, стандартное отклонение, относительное стандартное отклонение и доверительный интервал.
1. Среднее значение случайной величины (`x):
Эта величина при большом числе определений наиболее соответствует истинному значению.
`x = 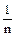
 i (1)
i (1)
2. Выборочная дисперсия (S2):
S2 =  (2)
(2)
3. Стандартное отклонение единичного измерения (S):
S = 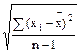 (3)
(3)
4. Стандартное отклонение средней величины (S`х):
S`х = 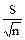 =
= 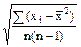 (4)
(4)
5. Относительное стандартное отклонение (Sr):
Sr = S /`x. (5)
1. 2 Исключение сомнительных результатов
Если серия данных содержит выпадающий результат, который значительно отличается от среднего, следует решить оставить его или исключить? При исключении результатов из малой выборки следует получить дополнительные данные взамен отбрасываемых. Нужно иметь в виду, что из выборки можно исключить не более 1/3 результатов. Если же выборка содержи более 1/3 результатов, подлежащих выбраковке, то вся выборка считается некорректной.
1.2.1 S- критерий
После вычисления стандартного отклонения абсолютных величины случайных отклонения | xi -`х | сопоставляют с величиной 3S. Если для всех хi выборки соблюдается условие:
çxi -`x ç < 3S, (6)
то все экспериментальные значения считают пригодными для расчета доверительного интервала. Если же для отдельных значений условие (6) не выполняется, то эти результаты могу быть исключены.
1. 2. 2. Q - критерий
Для исключения сомнительных результатов можно использовать Q - критерий. При проведении Q - теста все результаты определения располагают по порядку возрастания их величины и обозначают x1, x2,...xn. Для первого и последнего результатов рассчитывают:
Q1 =  и Q2 =
и Q2 = 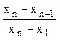 . (7)
. (7)
Больший из этих показателей (Q1 или Q2) сравнивают с табличным значением Q(Рдов,n) для заданной доверительной вероятности и числа определений n (таблица 1). Если полученное значение Q равно пли больше приведенного в таблице 1, то сомнительный результат отбрасывают.
Если результат x1 или xn будет отброшен, то число оставшихся результатов уменьшится на 1, и тогда Q - тест повторяют для n-1 значений. Так продолжают, пока не будут отброшены все результаты, полученные с грубыми ошибками. Для оставшихся результатов рассчитывают заново значения `x, S и S`x.
Таблица 1 - значения Q - теста в зависимости от числа определений (n) и принятой доверительной вероятности (Р).
| n\ P дов | ||||||||
| 0,90 | 0,94 | 0,76 | 0,64 | 0,56 | .0,51 | .0,47 | 0,44 | 0,41 |
| 0,95 | 0,98 | 0,85 | 0,73 | 0,64 | 0,59 | 0,54 | 0,51 | 0,48 |
| 0,99 | 0,99 | 0.93 | 0,82 | 0,74 | 0,68 | 0,63 | 0,60 | 0,57 |
Q -критерий используется для выявления промахов в выборках с числом определений 3 £ n £ 10.
1. 2. 3 Доверительный интервал
При помощи статистики можно установить такие пределы области вокруг экспериментально найденного среднего `х, в которых следует ожидать с данной вероятностью нахождение истинного значения. Пределы,, полученные таким образом, называются доверительными границами. Интервал, ограниченный этими пределами, называется доверительным интервалом.
Упомянутые величины имеют строгий математический смысл. Вероятность того, что найденное значение измеряемой величины лежит в интервале [m - sk, m + sk ], где m и s - соответственно среднее арифметическое и стандартное отклонение генеральной совокупности (n ®¥), есть доверительная вероятность. Численно доверительная вероятность равна  , где h(х) - функция Гаусса, а пределы интегрирования обозначают доверительный интервал a=m - sk, b=m+sk. Функция Гаусса описывает теоретически ожидаемое распределение экспериментальных результатов генеральной совокупности Функция Гаусса имеет вид:
, где h(х) - функция Гаусса, а пределы интегрирования обозначают доверительный интервал a=m - sk, b=m+sk. Функция Гаусса описывает теоретически ожидаемое распределение экспериментальных результатов генеральной совокупности Функция Гаусса имеет вид:
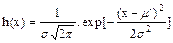 , (8)
, (8)
где x- единичное измерение, n - частота появления каждого значения х.
Для абсолютно правильного предсказания мы должны были бы выбрать достаточно большой интервал и включить в него все мыслимые значения, которые может принимать xi. Для аналитических определений такой интервал не имеет ценности. Если мы примем, что вероятность попадания в интервал составляют 99 правильных результатов из 100, он не будет столь большим. Его можно сделать еще меньше, если считать приемлемой вероятность 0,95.
Для ограниченного числа измерений доверительные границ средней величины рассчитывают, используя статистический критерий Стьюдента t=F(Pдов,f). В аналитической химии обычно принимают Рдов=0,95. Константу t для избранной доверительной вероятности и числа степеней свободы f= n-1, часто называемую коэффициентом Стьюдента, находят по таблице 2.
Таблица 2 - Значения коэффициентов Стьюдента
| f \Pдов | ||||||||||
| 0,95 | 12,7 | 4,30 | 3,18 | 2,78 | 2,57 | 2,45 | 2,37 | 2,31 | 2,26 | 2,23 |
| 0,99 | 63,6 | 9,93 | 5,84 | 4,60 | 4,03 | 3,71 | 3,59 | 3,36 | 3,25 | 3,17 |
С использованием коэффициента Стьюдента доверительный интервал выселяют как:
±t.S`x или ±t.S/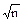 .
.
Таким образом, результат анализа представляют в:
`x ± t.S/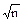 .
.
1. 2. 3 Значащие цифры
Результат анализа должен быть выражен числом, которое содержит только значащие цифры. Значащие цифры - это все достоверно известные цифры данного числа плюс первая недостоверная цифра.
Для оценки достоверности результатов аналитических определений следует учитывать реальные возможности используемого метода или методики. В качестве статистических критериев при этом может служить, например, стандартное отклонение или доверительный интервал. При отсутствии конкретных данных считают, что недостоверность последней цифры равна ± 1.
Нуль, стояний в середине или в конце числа, является значащей цифрой. При правильной записи результата анализа нули, которые не являются значимыми, следует исключить, а результат анализа представить в виде числа, содержащего произведение значащих цифр на 10n.Например, если число 1250 содержит три значащие цифры, то правильно его представить в виде 1,25-103, а если в этом же числе четыре значаще цифры, то следует записать его как 1,250-103.
Нули, стоящие в начале числа, не являются значащими, они лишь показывают место запятой в десятичной дроби. Например, значение массы образца 0,03750г можно представить в виде 3,750-10-2г, если взвешивание проводили на микровесах с точностью до ± 0,00002 г; а если взвешивание проводил на аналитических весах с точностью до ± 0,0002 г, то правильное представление результата: 0,0375 г или 3,75-10-2 г.
Незначащие цифры исключают, округляя число. При этом, если отбрасываемая цифра меньше 5, последняя значащая цифра не изменяется. Если отбрасываемая цифра больше или равна 5, последняя значащая цифра увеличивается на единицу. Если за первой недостоверной цифрой следует цифра 5, то применяют другое правило: округляют цифру 5 до ближайшего четного числа.
Количество значащих цифр в числе, полученном в результате всех вычислений, определяется из сравнения недостоверности чисел. При сложении и вычитании количество знаков обусловлено числом, которое имеет наибольшую абсолютную недостоверность и наименьшее количество десятичных знаков. При умножении и делении количество значащих цифр обусловлено числом, имеющим наибольшую относительную недостоверность. Логарифмические величины должны содержать такое же количество значащих цифр (после запятой), как и использованные при расчете нестепенные числа. Например, рН раствора с концентрацией [Н+]= 1,7.10-4 М равен 0,77. Это объясняется тем, что цифры, полученные при логарифмировании степенного члена, не являются значащими.
В полумикроанализе (гравиметрия, титриметрия) результат должен быть представлен в виде числа, содержащего четыре значащие цифры, что связано с точностью измерений массы веществ и объемов растворов.
Пример расчета №1
Данные определения основного компонента в пробе лекарственного препарата представлены в таблице. Определить его истинное значение и рассчитать доверительный интервал.
| № | Х(%) | Хi -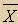
| (Х -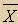 )2 )2
|
| 96,6 | +0,6 | 0,36 | |
| 95,4 | -0,6 | 0,36 | |
| 95,5 | -0,5 | 0,25 | |
| 96,5 | +0,5 | 0,25 | |
| 96,1 | +0,1 | 0,01 | |
| 95,9 | -0,1 | 0,01 | |
| 94,1 |

Проверим на промах величину, наиболее отличающуюся от результатов всей серии- 94,1%.
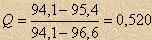
Табличные значения Q для n = 7 и Р = 95 % - 0,480, следовательно это значение является промахом и не включается в расчет среднего арифметического значения.

Пример №2
При определении массовой доли фосфорной кислоты в образце были получены результаты, приведённые в таблице. Рассчитать абсолютную и относительную ошибку опытов.
| № определения | Содержание  , г , г
| 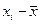
| 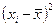
| S2, S |
| 0,7594 | +0,0010 | 0,00000100 | 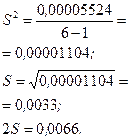
| |
| 0,7543 | -0,0041 | 0,00001681 | ||
| 0,7623 | +0,0039 | 0,00001521 | ||
| 0,7594 | +0,0010 | 0,00000100 | ||
| 0,7605 | +0,0021 | 0,00000441 | ||
| 0,7543 | -0,0041 | 0,00001681 | ||
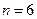
| 
| 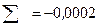
| 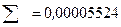
|
Стандартное отклонение среднего:
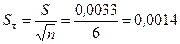 ;
;
Принимая надежность 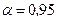 по таблицам для
по таблицам для 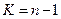 , т.е.
, т.е. 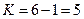 находим
находим 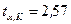 .
.
Тогда доверительный интервал:
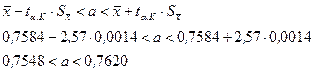
Абсолютная ошибка: 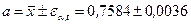 .
.
В заключении высчитывают относительную ошибку в процентах по формуле:
 ;
;
 .
.
Все результаты аналитической обработки сводятся в таблицу.

| 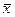
| 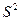
| 
| 
| 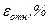
|
| 0,7584 | 0,00001104 | 0,0033 | 0,0036 | 0,45 |
Литература
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 16880; Нарушение авторских прав?; Мы поможем в написании вашей работы!