
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термометрия
|
|
|
|
Термометрия – один из наиболее популярных и простых методов установления ряда важных аналитических характеристик веществ. Термометрия включает измерение температур фазовых переходов веществ – плавления, кристаллизации, кипения. При нагреве или охлаждении вещества его температура меняется непрерывно, но в момент фазового перехода в некотором интервале наступает постоянство температуры, связанное с поглощением или выделением теплоты при изменении фазового состояния (рисунок 24). Постоянная температура, сопровождающая плавление, затвердевание или кипение вещества, остается стабильной до завершения фазового перехода и только после этого начинает изменяться дальше. Температуры фазовых переходов являются константами веществ и используются для определения их идентичности (по плавлению смешанных проб), проведения физико-химического анализа и определения молекулярных масс веществ по изменениям температуры фазового перехода основы.
Константы фазовых переходов являются важнейшими физико-химическими и идентификационными характеристиками веществ. Обычно определяют следующие константы: температуру плавления; температуру затвердевания; температуру кипения. При измерениях используют шкалу Цельсия, в которой за нулевую отметку принята температура плавления льда, за 100°С – температура кипения воды. Вторая шкала температур, рекомендуемая к использованию СИ, – термодинамическая шкала (в Кельвинах К), за нулевую отметку принимают температуру абсолютного нуля – ОК пли –273,16°С. Температура плавления льда в этой шкале соответствует 273,16 К. Для перевода температуры из шкалы Цельсия в термодинамическую шкалу Кельвина достаточно к значению температуры по Цельсию прибавить 273,16°. Измерение температуры проводят обычно с помощью ртутных термометров.
|
|
|
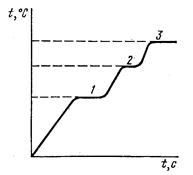
Рисунок 24 – Изменения температуры в момент фазового перехода:
1 – испарение кристаллизационной воды; 2 – плавление примеси; 3 – плавление вещества
5.2 Термогравиметрия и дифференциальные термические методы анализа
Термогравиметрический анализ основан на регистрации изменений массы образца вещества при его нагревании, сопровождающемся его высушиванием, разложением. Эти процессы могут идти в несколько стадий. Например, при высушивании сначала удаляется свободная, затем – более прочно связанная кристаллизационная влага. При дальнейшем нагревании проходят процессы пиролиза вещества, которые также могут быть многостадийными. Каждый из указанных процессов проходит при достижении для данного вещества одной постоянной температуры и сопровождается потерей массы. Поэтому на графике зависимости массы образца от температуры нагрева при некоторых температурах регистрируются изменения массы, соответствующие определенным стадиям термических превращений вещества. Например, термические превращения CuSO4 • 5Н2О (рисунок 25, а) складываются из следующих стадий: 1) удаление двух молекул воды (t = 60…80°С); 2) удаление двух молекул воды (t=105…115° С); 3) удаление одной молекулы воды (t = 220…240°С); 4) разложение до CuO (t = 700…750°С); 5) разложение до Cu2O (t = 900…950°С).

Рисунок 25 – Термогравиграмма (а) и кривые ДСК и ДТА (б) сульфата меди (II)
Таким образом, термогравиграмма позволила установить, что кристаллизационная вода связывается в сульфате меди по крайней мере тремя видами связи, отличающимися своей прочностью. При этом изменения массы образца эквивалентны содержанию в нем разных форм воды и продуктов разложения. Приведенный пример показывает высокую эффективность термогравиметрического анализа как метода исследования состава веществ.
|
|
|
Термогравиметрический анализ проводят на специальных термовесах (рисунок 26, а), включающих устройства 4 (печь) для нагрева образца 3, регулирования температуры и давления, регистрирующие весы 9, датчики температуры 2 и массы 10 и самописец 1 для записи показаний термовесов. Термогравиметрический анализ получает широкое развитие как точный и чувствительный метод для определения составных частей веществ и примесей в них. Термические характеристики примесей отличаются от характеристик вещества и на термогравиграмме появляются соответствующие изменения, качественно и количественно связанные со свойствами примеси.
Метод калориметрии основан на измерении теплового потока, поглощаемого или излучаемого веществом в процессе его нагрева. В момент фазовых переходов или химических превращений образец вещества поглощает или выделяет определенное количество теплоты, что регистрируется чувствительными термоэлементами, помещенными в образец. Обычно используют дифференциальный вариант калориметрии, называемый дифференциальной сканирующей калориметрией – ДСК. В ДСК измеряется разность тепловых потоков образца и инертного неизменяющегося стандартного вещества, нагреваемых с одинаковой скоростью. При графическом изображении на кривой ДСК при отсутствии фазовых или химических изменений в веществе фиксируется прямая линия. При появлении в веществе изменений, сопровождающихся поглощением теплоты (расплавление, испарение и др.), на кривой появляется экзотермический пик, направленный вниз; если изменения связаны с выделением теплоты, появляется эндотермический пик, направленный вверх (см. рисунок 25, б).
К методу ДСК близок по своей сути метод дифференциального термического анализа ДТА. В этом методе регистрируют разность температур нагреваемого образца и стандарта, устойчивого при нагревании. При фазовых переходах, химических превращениях температура образца вследствие выделения или поглощения теплоты соответственно повышается или понижается. Эти изменения температуры регистрируются на кривой ДТА, аналогичной по своей форме кривой ДСК. Приборы ДТА проще по устройству и состоят из термопечи 4, в которую помещены держатели образца 3 и стандарта 7 с термопарами 11, регуляторов нагрева печи 5 и состава среды 6 и регистратора 1 (самописца) с усилителем 8 разности температур (рисунок 26, б).
|
|
|

Рисунок 26 – Схемы установок для термического анализа
Абсорбция – поглощение веществ из газа (обычно из газовой смеси) или жидкости или – реже – твёрдыми веществами.
Абсорбционная спектроскопия – раздел спектроскопии, изучающий спектры поглощения видимого, ИК - и УФ – излучения.
Амперометрическое титрование – электрохимический метод количественного анализа, в котором конечную точку титрования находят по зависимости предельного диффузионного тока Id, соответствующего данному электрохимическому веществу от объёма прибавленного титранта.
Атомно-абсорбционный анализ (атомно-абсорбционная спектроскопия) – метод элементного анализа вещества по атомным спектрам поглощения.
Атомные спектры – совокупность длин волн (частот, волновых чисел) электромагнитного излучения в УФ, видимой и ИК области, поглощаемого или испускаемого при квантовых переходах между уровнями энергии свободных или слабовзаимодействующих атомов или атомных ионов.
Вольтамперометрия – электрохимический метод количественного и качественного анализа веществ, основанный на определении зависимости между силой тока I в цепи электрохимической ячейки и напряжением поляризации Е при электролизе раствора или расплава вещества.
Гальванические элементы – химические источники тока, состоящие из одной гальванической ячейки.
Двойной электрический слой – тонкий поверхностный слой из пространственно разделённых электрических зарядов противоположного знака, образующиеся на границе раздела двух фаз.
Ионселективные электроды – электроды, состоящие из мембраны, проницаемой только для определённых электродноактивных ионов, и стандартного раствора, содержащего эти ионы.
|
|
|
Калориметрия – совокупность методов измерения количества теплоты выделяющейся или поглощаемой в различных физических или химических процессах.
Кондуктометрия – совокупность электрохимических методов анализа веществ, основанных на измерении электрической проводимости растворов.
Люминесцентный анализ – совокупность методов анализа, основанных на явлении люминесценции.
Люминесценция – свечение вещества, возникающее после поглощения им энергии возбуждения; представляет собой избыточное излучение по сравнению с тепловым излучением тепла при данной температуре.
Масс-спектрометрия – метод исследования и анализа веществ, основанный на ионизации атомов и молекул, входящих в состав пробы и регистрации спектра масс образовавшихся ионов.
Нефелометрия – метод количественного анализ по интенсивности света, рассеянного взвесью определяемого вещества.
Оптическая плотность – способность вещества поглощать свет:
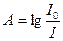 , измеряют с помощью спктрометров.
, измеряют с помощью спктрометров.
Оптические (молекулярные) спектры – совокупность полос или линий в оптической (УФ -, видимой, ИК -) и микроволновой (МВ) областей электромагнитных волн, возникающих в результате изменения энергии молекул при поглощении, рассеянии или испусканием электромагнитного излучения.
Поляриметрия – метод измерения величины вращения плоскости поляризации света при прохождении его через оптически активные вещества.
Потенциометрия – электрохимический метод исследования и анализа, основанный на определении зависимости между равновесным электродным потенциалом Е и термодинамической активностью компонентов, участвующих в электрохимической реакции.
Рентгеновская спектроскопия – метод изучения рентгеновских спектров испускания (эмиссионная) и поглощения (абсорбционная) рентгеновская спектроскопия.
Рефрактометрия – совокупность методов анализа и исследования вещества, основанных на измерении его показателя преломления n (коэффициент рефракции).
Спектральный анализ – совокупность методов определения элементного и молекулярного состава веществ, основанных на изучении их спектров электромагнитного излучения.
Термический анализ – метод исследования физико-химических процессов и химических превращений происходящих в веществе в условиях программированного изменения температуры.
Термогравиметрия – метод термического анализа, основанный на регистрации зависимости массы образца от температуры.
Турбидиметрия – метод количественного анализа по интенсивности света, поглощённого взвесью определяемого вещества.
Фотометрический анализ - совокупность методов качественного и количественного анализа по интенсивности ИК, видимого и УФ излучения. Часто под фотометрическим анализом понимают молекулярно-абсорбционный метод, основанный на избирательном поглощении электромагнитного излучения в ИК, видимой и УФ области молекулами определяемого компонента или его соединения с соответствующим реагентом.
Фотометрия пламени (пламенная фотометрия) – оптический метод количественного анализа по атомным спектрам поглощения (абсорбционная фотометрия пламени) или испускания (эмиссионная).
Хроматография – метод разделения, анализа и физико-химического исследования веществ. Основан на различии скорости движения концентрационных зон исследуемых объектов, которые перемещаются в потоке подвижной фазы вдоль слоя неподвижной.
Электроды – электронно-проводящие фазы (металлы и полупроводники), контактирующие с ионным проводником (электролитом).
Электроды сравнения – применяют для измерения электродного потенциала, их потенциалы стабильны и воспроизводимы.
Электролиз – процесс протекания химических реакций под действием электрического тока на электродах, помещённых в раствор, расплав или твёрдый электролит.
Электролизёр – аппарат для проведения электролиза с цель получения определённых продуктов.
Электроосаждение – выделение металла на катоде в виде плотного или порошкообразного осадка.
Электропроводность электролитов – процесс, обусловленный существованием ионов, возникающих в результате электролитической диссоциации.
Электрохимия – раздел химии, изучающий физико-химические свойства ионных систем (растворов, расплавов или твёрдых электролитов), а также явления, возникающие на границе двух фаз с участием заряженных частиц.
Эмиссионный спектральный анализ - метод элементного анализа по атомным спектрам испускания.
Ядерный магнитный резонанс – избирательное взаимодействие магнитной компоненты радиочастотного электромагнитного поля с системой ядерных магнитных моментов вещества.
Литература
1. Основы аналитической химии. /Под ред. Ю. А. Золотова. -Кн. 1-2.-М.: Химия, 1999,
2. Лебухов В.И., Окара А.И., Павлюченкова Л.П. Физико-химические свойства и методы потребительских товаров. – Хабаровск: Хабаровская ГАЭиП, 1999. – 252с.
3. Николаева М.А. Товароведение потребительских товаров. – М.: Норма, 1997. – 284 с.
4. Аналитическая химия. Кн.2. Физико-химические методы анализа. –М.: Дрофа, 2001. –340 с.
5. Парамонова Т.Н. Экспресс-методы оценки качества продовольственных товаров. – М.: Экономика, 1988. – 112 с.,5 экз.
6. Аносов В.Я. Основы физико-химических методов анализа. – М.: Наука, 1976. – 503 с.,
7. Васильев В.П. Теоретические основы физико-химических методов анализа. – М.: Высш. шк., 1979. – 184 с.
8. Барковский В.Ф. и др. Практикум по физико-химическим методам анализа. – М.: Высш. шк., 1963. – 350 с
9. Чечёткина Н.М., Путилина Т.И., Горбунёва В.В. Товарная экспертиза. – Ростов-на-Дону: Феникс, 2000. – 512 с.
10. Бок Р. Методы разложения в аналитической химии. – М.: Химия, 1984. – 428с.
11. Берштейн И.Я., Каминский Ю.Л. Спектрофотометрический анализ в органической химии. – Л.: Химия, 1975. – 230 с.
12. Булатов М.И., Калинкин И.П. Практическое руководство по колориметрическим и фотометрическим методам анализа. – Л.: Химия, 1986. – 432 с.
13. Иоффе Б.В. Рефрактометрические методы химии. – Л.: Химия, 1983. – 350с.
14. Выдра Ф., Штулик К., Юлакова Э. Инверсионная вольтамперометрия. – М.: Мир, 1980. – 278 с.
15. Берёзкин В.Г., Бочков А.С. Количественная тонкослойная хроматография: инструментальные методы. – М.: Наука, 1980. – 183 с.
16. Айвазов Б.В. Основы газовой хроматографии. – М.: Высш. шк., 1977. – 183с.
17. Киселёв А.В., Яшин Я.И. Адсорбционная газовая и жидкостная хроматография. М.: Химия, 1979. – 288 с.
18. Доерфель К. Статистика в аналитической химии. – М.: Мир, 1969. – 196 с.
19. Чарыков А. К. Математическая обработка результатов химического анализа. Методы обнаружения и оценки ошибок. – М.: Химия. 1984. – 54 с.
20. Лурье Ю.Ю. Справочник по аналитической химии. -М.: Химия. 1979. – 480с.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1425; Нарушение авторских прав?; Мы поможем в написании вашей работы!