
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы получения. Тетрафторид урана (UF4) из всех галогенидов урана имеет в технологии особое значение поскольку он является:
|
|
|
|
Основные свойства
Тетрафторид урана.
Тетрафторид урана (UF4) из всех галогенидов урана имеет в технологии особое значение поскольку он является:
- исходным соединением для получения UF6;
- исходным соединением для получения металла;
- компонентом ядерного топлива в жидкосолевом реакторе.
Кристаллическая структура UF4 моноклинная. В технологии соединение также известно под названием «зелёная соль».
Плотность r (теор.) = 6,7±0,1 г/см3, r (практ.) = 6,43÷6,85 г/см3.
Насыпной вес α = 1,5÷3,5 г/см3.
Температуры фазовых переходов t (плавл.) = 1036 ± 2 оС, t (крист.) = 960 ± 5 оС, t (кипения) = 1450 оС.
Давление пара UF4 над твёрдой фазой описывается следующим уравнением (р – мм.рт.ст.):
lg(pUF4) = (38,01±0,22) – (20058±243)/T – 7,05 lgT
над жидкой фазой:
lg(pUF4) = (37,09±0,03) – (16840±44)/T – 7,55 lgT
Технологические способы получения тетрафторида урана делят на три большие группы – сухие, полусухие и мокрые, в зависимости от используемых фторирующих реагентов.
I – Сухие способы
1. Взаимодействие оксидов урана с газообразным фтористым водородом. Процесс проводится при температурах выше 550 oC. Примеры реакций представлены ниже:
UO2 + 4 HF → UF4 + 2 H2O
U3O8 + 2 H2 + 12 HF → 3 UF4 + 8 H2O
Фторирование проводят в шнековых аппаратах – горизонтальных цилиндрических печах с вращающимися шнековыми мешалками. Движение твёрдого и газообразного продуктов осуществляется по принципу противотока; шнек выполняет роль транспортёра и мешалки. Материал аппаратуры – никель, диаметр 400 мм, длина – 6 м.
Чем выше температура – тем больше тетрафторида урана гидролизуется и тем, следовательно, необходимо большее парциальное давление паров фтористого водорода для подавления гидролиза. При противоточном фторировании для максимального использования фтористого водорода необходимо проводить процесс при минимальных температурах, но при этом мала скорость реакции. При высоких температурах необходим большой избыток фтористого водорода. Это было бы просто (оставлять часть HF циркулировать в системе) если бы не высокая стоимость осушки HF (значительная часть стоимости HF падает на его обезвоживание).
|
|
|
Из-за совокупности этих причин в шнековых аппаратах необходим градиент температуры; на выходе из аппарата температура максимальна, на входе – минимальна. В свежем HF отсутствует влага и температура здесь может быть весьма значительна (500-600 оС) – обеспечивается высокая скорость процесса. По мере увеличения содержания паров воды температура понижается и на выходе составляет 300-400 оС. На практике температурный градиент не достигается; используют серию аппаратов, работающих при разных температурах.

Технологическая схема процесса сухого фторирования диоксида урана.
1 – фильтр, 2 – конденсатор для 70%-ной плавиковой кислоты, 3 – конденсатор для сухого HF, 4 – смеситель.
Можно использовать и цепь аппаратов «кипящего слоя», в которых просто создать градиент температуры. Возрастает поверхность контакта фаз и, следовательно, увеличивается интенсивность фторирования. Аппараты не имеют движущихся частей.
С целью уменьшения содержания кислорода в получаемом продукте (присутствующем в виде фторида уранила) процесс гидрофторирования можно вести смесью фтористого водорода и газа-восстановителя. В качестве восстановителя можно использовать водород или аммиак, который при повышенной температуре диссоциирует с образованием N2 и Н2. Однако, следует иметь в виду, что увеличение продолжительности процесса в этом случае приводит наряду с уменьшением количества образующегося UO2F2 к повышению содержания UO2 в конечном продукте. В таблице ниже отражено влияние продолжительности гидрофторирования на состав конечного продукта. Процесс проводили при 450 оС, состав газа, %: HF – 84, N2 – 11, H2 – 5.
|
|
|
| Продолжительность, час | Состав конечного продукта | ||
| UF4, % | UO2, % | UO2F2, % | |
| 1,5 | 96,5 | 2,4 | 0,29 |
| 3,0 | 95,7 | 2,6 | 0,34 |
| 4,5 | 96,5 | 2,5 | 0,31 |
| 6,0 | 93,4 | 4,5 | 0,30 |
| 7,5 | 94,8 | 3,5 | 0,24 |
| 9,0 | 94,6 | 3,9 | 0,22 |
| 10,5 | 93,7 | 4,8 | 0,24 |
| 12,0 | 91,7 | 6,7 | 0,14 |
| 13,5 | 93,5 | 5,3 | 0,16 |
Если на гидрофторирование поступает диоксид урана, полученный восстановлением триоксида, то полнота и скорость процесса определяются и «историей» восстановления UO3. Зависимость протекания процесса гидрофторирования от температуры восстановления UO3 представлена на рисунке.
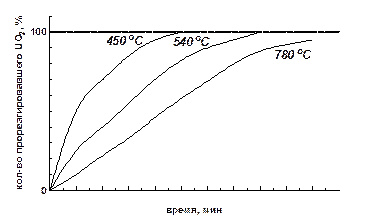
Зависимость полноты протекания процесса гидрофторирования диоксида урана от температуры в процессе восстановления UO3 до UO2
Диоксид урана, полученный восстановлением триоксида при низкой температуре более реакционноспособен. Скорость гидрофторирования возрастает если UO2 частично перевести в U3O8.
2. Фторирование с помощью бифторида аммония. Реакция протекает ступенчато (в зависимости от температуры), продукты разложения аммиака выступают в качестве восстановителя для урана:
2 UO3 + 5 NH4HF2 → 2 NH4UF5 + 3/2 N2 + 5/2 H2 + 6 H2O T < 450 oC
UO3 + 2 NH4HF2 → UF4 + N2 + 2 H2 + 3 H2O T > 700 oC
3. Фторирование фреонами. Можно использовать различные фреоны, например, фреон-11 – фтортрихлорметан CCl3F tкип. = 178 оС или фреон-114 – тетрафтордихлорэтан C2Cl2F4:
UO3 + 4 CCl3F → UF4 + 3 COCl2 + Cl2 T = 400 oC
UO3 + 4 C2Cl2F4 → UF4 + CO2 + CO + Cl2 T = 700 oC
Достоинство этого метода фторирования заключается в том в конечных продуктах нет воды, соответственно не создаются условия для гидролиза тетрафторида урана.
4. Восстановление гексафторида урана водородом. Метод важен при получении металлического топлива на основе обогащённого урана. Процесс проводят при температуре около 800 oC.
UF6 + H2 → UF4 + 2 HF
5. Восстановление гексафторида урана четырёххлористым углеродом. Четырёххлористый углерод, в отличие от водорода, не пожаро- и не взрывоопасен. Однако его использование в промышленных масштабах в настоящее время сокращается из-за отрицательного влияния на озоновый слой. Реакция протекает при температуре выше 150 oC и идёт бурно:
UF6 + CCl4 → UF4 + CCl2F2 + Cl2
При избытке CCl4 возможен следующий процесс:
|
|
|
UF6 + 2 CCl4 → UF4 + 2 CCl3F + Cl2 ΔНо = -53 ккал/моль
При реализации сухих способов получения тетрафторида урана очень важны материалы для аппаратов (автоклавов и печей непрерывного действия). Используются сплавы на основе никеля:
монель-металл (масс.%): Cu - 27÷29, Fe - 1.5÷2.0, Mn - 1÷2;
хастелои – тройные сплавы Ni-Mo-Fe;
или, например, ИНОР-8: Mo-17, Cr-7, Fe<5.
II – Полусухой способ
В основе способа лежит реакция диоксида урана с водными растворами плавиковой кислоты. При этом образуется гидрат тетрафторида урана(IV).
UO2 + 4 HF + (n-2) H2O → nUF4·H2O
Основная проблема заключается в обезвоживании полученного гидрата, в зависимости от температуры сушки получаются гидраты с различным содержанием воды:
T < 40 oC – 2UF4·5H2O
40 < T < 60 oC – 2UF4·5H2O + UF4·H2O
60 < T < 100 oC – UF4·H2O
105 < T < 200 oC – 2UF4·H2O
T > 400 oC – UF4
Чем выше температура, тем сильнее UF4 подвержен гидролизу, например:
2UF4·H2O → UF4 + U(OH)F3 + HF T < 400 oC
Гидролиз тетрафторида сильно осложняет задачу получения безводного чистого UF4.
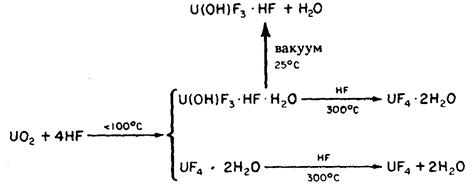
Реакции, протекающие при гидрофторировании диоксида урана
Гидрофторирование урана требует соблюдения определённых условий. Рост кристаллов UF4 – важнейший этап его получения. Растворимость UF4 в воде: при 25 оС – 23,8 мг/л; при 60 оС – 95,2 мг/л ≈ 0,1г/л. Тогда как при 25 оС в растворах соляной кислоты: в 1 М HCl – 1,4 г/л; в 6 М HCl – 9,2 г/л. На поверхности частиц диоксида образуется слой тетрафторида и реакция замедляется. Необходимо создать условия для переноса ионов урана.
В производственном процессе используют пульпу UO2 (с d ≈ 2,5 г/см3), соотношение Т:Ж = 1:3,5. Фторирование ведётся смесью HF + HCl (≈ 1:1) – HF - 50÷60 г/л; HCl - 60 г/л. Туда же прибавляют отходы металлического урана. Получающийся, так называемый, «комплексный раствор» содержит [UCl4F2]2- и [UCl4F]-. Состав раствора изменяется от [UCl4F2]2- и [UCl4F]- по мере вывода F- в осадок UF4.
Рост более крупных кристаллов тетрафторида урана происходит за счёт растворения мелких. Но для этого должна быть обеспечена «связь», обеспечивающая массоперенос. Комплексные хлоридно-фторидные ионы и служат этим «мостиком».
|
|
|
III – Мокрые способы
В основе этой группы способов лежат химические реакции, протекающие в жидкой фазе и приводящие к осаждению UF4.
1. Непосредственное осаждение из водных растворов. К раствору, содержащему ионы урана(IV), прибавляют раствор плавиковой кислоты.
U4+ + 4 F- + n H2O → UF4·nH2O
Присутствующие в растворе анионы также принимают участие в реакциях, при этом образуются промежуточные комплексы:
U4+ + 2 SO42- + 2 F- → [U(SO4)2F2]2-
[U(SO4)2F2]2- + 2 F- → UF4·nH2O + 2 SO42-
Вывод из этой последовательности реакций: условия формирования зародышей и роста кристаллов нужно соблюдать лишь после введения в раствор половины необходимого количества F-.
Подобным образом можно получать и двойные соли: NH4UF5·nH2O или КUF5·nH2O:
[U(SO4)2F2]2- + NH4+ + 3 F- → NH4UF5·nH2O + 2 SO42-
Восстановление урана до U(IV) производят с помощью ионов Sn2+, S2O42- или электрического тока.
Если уран находится в кислом растворе, то в качестве химического восстановления можно использовать гидросульфит (дитионит) натрия:
2 UO2Cl2 + Na2S2O4 + 4 HCl = 2 UCl4 + Na2SO4 + SO2 + 2 H2O
Используют 60 г/л HСl для полного восстановления и предотвращения гидролиза.
В сернокислых растворах уран восстанавливают железной стружкой:
UO22+ + 4 Н+ + Fe = U4+ + Fe2+ + 2 H2O
При электрохимическом восстановлении используют электролиз урансодержащих водных растворов в свинцовом электролизёре. Катодом является корпус аппарата, анодом – свинцовая пластина.
Катод: UO22+ + 2 e = U4+ + 2 O2-
Aнод: SO42- - 2 e = SO3 + ½ O2
Для предотвращения выпадения U(SO4)2 в раствор вводят комплексообразователи - ионы аммония.
2. Фотохимический синтез. Реакция протекает в кислых растворах. Восстановителем является этанол, который окисляется до уксусного альдегида (этаналя):
UO22+ + C2H5OH + 2 H+ + 4 F- + hν + ½ H2O → UF4·2.5H2O + C2H4O
Обезвоживание UF4 является сложной задачей и в этом заключается существенный недостаток полусухого и мокрого способов. Как было сказано ранее:
2 UF4·H2O → UF4 + U(OH)F3 + HF T > 200 oC
При доступе воздуха возможно образование уранил фторида:
U(OH)F3 + 1/2 O2 → UO2F2 + HF
Но гораздо хуже, если окисление приведёт к образованию летучего гексафторида урана:
2 UF4 + O2 → UO2F2 + UF6 T > 800 oC
Поэтому сушку UF4 проводят в атмосфере водорода:
4 U(OH)F3 → 3 UF4 + UO2 + 2 H2O T > 600 oC
2 UO2F2 + 2 H2 → UF4 + UO2 + 2 H2O T > 600 oC
Обычно продукт высушивают при Т ~ 700 оС в течение 15-20 мин. Остаточная влажность терафторида составляет менее 0.1 %, содержание UO2 не более 1.5 %. Насыпной вес кристаллов UF4 α = 2,5÷3,5 г/см3.
В зависимости от назначения тетрафторида устанавливаются кондиционные требования на многие загрязнения:
Fe, Si, Al, Cr, Ni (~ n·10-3 масс.%)
K, Na (~ n·10-2 масс.%)
Mn (~ n·10-4 масс.%)
Cu, B (~ n·10-5 масс.%)
Черновой уран, полученный при восстановлении тетрафторида, концентрирует в себе все примеси, содержащиеся в UF4, поэтому исходный тетрафторид урана должен быть достаточно чистым.
Если тетрафторид используется для производства гексафторида, то UF6 можно легко очистить от нелетучих фторидов Fe, Ni, Ca, Mg и др. Летучие же фториды (Mo, V, Si, Cr и т.д.) отделять трудно и их содержание должно быть мало. Лимитируется и содержание UO2 и UO2F2, т.к. их фторирование до гексафторида сопряжено с большим расходом фтора.
Для сравнения сопоставим температуры фазовых переходов летучих фторидов:
| Фторид | Т-ра плавления, оС | Т-ра Р = 760 мм рт.ст., оС |
| MoF6 | 17,4 | 35,0 |
| WF6 | 2,3 | 17,0 |
| UF6 | 64,8 | 56,4 |
| NpF6 | 54,4 | 55,2 |
| PuF6 | 50,8 | 62,2 |
Гексафторид урана. Свойства. Способы получения. Применение гексафторида для разделения изотопов урана
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2466; Нарушение авторских прав?; Мы поможем в написании вашей работы!