
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Для определения среды водных растворов
Кислотно-основными индикаторами называют вещества, меняющие свою окраску в определенной области значений рН раствора. Индикаторами могут быть слабые органические кислоты (HInd) и основания (IndOH), молекулы и ионы которых имеют разную окраску. При введении в исследуемый раствор индикаторы диссоциируют по одному из механизмов соответственно:
а) HInd  H+ + Ind-;
H+ + Ind-;
б) IndОН  Ind- + ОН- .
Ind- + ОН- .
Так как процессы диссоциации а) и б) обратимы, положение равновесия зависит от кислотности исследуемого раствора. В кислой среде индикаторы типа HInd в соответствии с принципом Ле-Шателье находятся преимущественно в виде молекул, и окраска соответствует молекулярной форме. Индикаторы-основания (IndОН) в кислой среде, напротив, будут присутствовать в своей ионной форме, которая обусловливает их соответствующую окраску, а в щелочной среде – в молекулярном виде.
Выражение для константы диссоциации кислотного индикатора имеет вид:
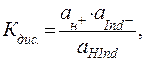 (40)
(40)
откуда 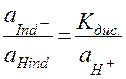 , где
, где 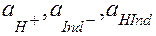 - равновесные активности (концентрации) ионов Н+, кислотного индикатора в ионной форме и индикатора в молекулярной форме соответственно.
- равновесные активности (концентрации) ионов Н+, кислотного индикатора в ионной форме и индикатора в молекулярной форме соответственно.
1.Если  >
>  ,
, 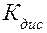 >
>  , то раствор имеет окраску иона.
, то раствор имеет окраску иона.
2.Если  <
< 
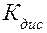 <
<  , то раствор имеет окраску недиссоциированной кислоты.
, то раствор имеет окраску недиссоциированной кислоты.
3.Если  =
= 
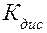 =
=  , то происходит смена окраски.
, то происходит смена окраски.
Из уравнения (41) после логарифмирования и перемены знаков можно прийти к выражению для рН в состоянии равновесия:
 (42)
(42)
где  .
.
 . (43)
. (43)
Из уравнения (43) следует, что изменение рН приводит к изменению соотношения основной и кислотной форм индикатора, а следовательно и к изменению цвета. Интервал, в котором глаз воспринимает переходный цвет, называется интервалом перехода индикатора. Он находится в границах рН:
рН = рКдис.HInd  1. (44)
1. (44)
Например, если константа индикатора КHind ≈ 10-7, то рКHind = 7, а интервал воспринимаемого перехода цвета находится в пределах значений рН от 6 до 8.
Таблица16
Характерная окраска и интервалы перехода некоторых индикаторов
| Индикатор | Интервал перехода рН | Окраска в более кислом растворе | Окраска в более щелочном растворе |
| Метиловый оранжевый | 0,0 ÷ 2,0 | Красная | Желтая |
| Метиловый красный | 3,1 ÷ 4,4 | Красная | Желтая |
| Лакмус | 6,0 ÷ 8,0 | Красная | Синяя |
| Фенолфталеин | 8,2 ÷ 10,0 | Бесцветная | Малиновая |
| Ализариновый желтый | 10,1 ÷ 12,1 | Желтая | Оранжевая |
Окраска универсального индикатора (смеси индикаторов) изменяется от красной (при рН<3,4) через оранжевую (рН 3,4 – 4,7), желтую (рН 4,7 – 6,2), зеленую (рН 6,2 – 7,2), голубую (рН 7,2 – 8,5) до фиолетовой (рН >8,5) (табл.16).
Для того, чтобы можно было пренебречь влиянием на рН реакционной среды самих индикаторов, их используют в очень небольших количествах.
.
|
Дата добавления: 2014-01-07; Просмотров: 421; Нарушение авторских прав?; Мы поможем в написании вашей работы!