
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Клетки бактерий, устойчивых к фагу, образуют колонии на среде, содержащей фаг Клетки чувствительных бактерий колоний не образуют
|
|
|
|
Легко продемонстрировать, что клетки, находящиеся в составе выросших колоний, устойчивы к вирусу, и способны передавать это свойство своему потомству. Колонии устойчивых клеток очень легко и удобно пересчитывать. Все мы умеем считать. Можно взять и посчитать, сколько колоний выросло на этой или какой то другой чашке. Мы, собственно, этим и займемся. И с помощью таких простых подсчетов, мы определим, как возникают мутации у бактерий: по ламарковскому или дарвиновскому механизму.
Итак, как же возникают устойчивые бактерии? Если мы придерживаемся ламарковской парадигмы, мы должны сказать, что в отсутствие вируса устойчивых бактерий быть не должно. Бактерии становятся устойчивыми к вирусу в ответ на изменение окружающей среды, в ответ на то, что мы добавили вирус. С другой стороны, если мы находимся в рамках дарвиновской парадигмы, то мы должны сказать, что за счет имманентной изменчивости в популяции бактерий всегда присутствуют спонтанно возникшие, устойчивые к вирусу бактерии. А вирус просто выступает в качестве агента отбора. Вирус — это карающая “длань господня”, которая пришла и отделила зерна от плевел. Как же нам выяснить, что происходит на самом деле? Давайте проведем мысленный эксперимент. Посмотрим, что должно происходить в случае ламарковской ситуации, когда мутации устойчивости к бактериофагу возникают только после контакта с ним. На слайде схематически изображен голубенькая бактериальная клетка, которая размножается путем деления. После первого деления возникло две дочерние клетки. Произошло еще одно деление, дочерние клетки поделились, стало четыре клетки, затем восемь. После четырех делений у нас получилось 16 клеток. А теперь эти 16 клеток высеяли на питательную среду, которая плотно заселена вирусом. До того, как вирус был предложен этим клеткам, они знать про него не знали и были к нему чувствительны, как и исходная клетка. Пусть в ответ на появление вируса с какой-то частотой возникают устойчивые к нему клетки. Первый раз мы высеяли наши 16 клеток на чашку с вирусом, и так получилось, что у нас выросли три устойчивые колонии. Т.е., три из шестнадцати клеток приобрели устойчивость за счет какого-то адаптивного ответа на вирус. Проведем эксперимент еще раз, опять начав его с единичной (другой) чувствительной клетки. Во второй раз у нас выросла одна колония. В третий раз — сразу пять. А в четвертый раз ничего не выросло. Очевидно, что есть какой-то разброс, но в целом наши данные позволяют расчитать некоторую среднюю вероятность адаптации каждой клетки к вирусу.
|
|
|
Сценарий 1 (ламарковский): мутации устойчивости к фагу возникают после контакта с ним

Теперь давайте посмотрим на дарвиновский сценарий, когда мутации возникают спонтанно и лишь отбираются при добавлении вируса. Вот опять пошла наша клетка делиться, после третьего деления у одной дочерней клетки спонтанно возникла устойчивость, но вируса еще нет. Устойчивая клетка, как и все остальные, поделилась еще раз и дала две дочерние клетки, которые тоже устойчивы Мы высеяли наши 16 клеток на селективную среду с вирусом. И у нас выросли две колонии. В общем, никакой принципиальной разницы с тем, что было до этого, мы пока что не наблюдаем.
Сценарий 2 (дарвиновский): мутации предсуществуют, возникают спонтанно и отбираются при добавлении фага

Давайте повторим этот эксперимент еще раз. В этот раз у нас спонтанных мутаций устйчивости не возникло. Все клетки чувствительны, и при высеве на среды с вирусом не выжил никто, т.е., мы вообще не наблюдаем колоний. И в третьем эксперименте тоже так случилось. Пустая чашка!
|
|
|
Сценарий 2 (дарвиновский): мутации предсуществуют и отбираются при добавлении фага

Мы делаем еще один эксперимент. И тут случилось так, случайно - ведь мутации возникают спонтанно, - что клетка возникла очень рано, после первого деления материнской клетки. И она давала потомство, так же, как и все остальные. К моменту, когда мы высеяли всю эту культуру, состоящую из 16-ти клеток, на селективную среду, половина клеток оказались устойчивыми.
Сценарий 2 (дарвиновский)

Теперь вопрос: можем ли мы сказать, какой механизм более вероятен: дарвиновский или ламарковский, - просто глядя на количество устойчивых к вирусу колоний, наблюдаемых при повторении нашего простого эксперимента? На следующем слайде одновременно представлены результаты четырех независимых повторений нашего мысленного экаперимента для ламарковского и дарвиновского механизмов. Черным отмечены клетки, которые дали колонии на селективной среде.

Всего бактерий 256 (4x64)
Устойчивых мутантов: 10
В целом, распределение устойчивых колоний в случае ламарковского механизма представляется довольно равномерным. А в случае дарвиновского механизма распределение очень неровное, у нас есть, где пусто, а есть, где густо. При этом общее количество устойчивых клеток у нас для обоих механизмов одинаковое, для обоих механизмов мы в четырех сериях эскпериментов высевали на среды с вирусом 256 (4 по 64) клеток и получали 10 устойчивых колоний. Т.е., общая частота возникновения устойчивых колоний одинаковая, но распределение их разное. Можно применить математику и показать, что в случае ламарковского механизма имеет место хорошо известное пуассоновское распределение числа устойчивых колоний в разных сериях экспериментов, а в случае дарвиновского механизма — специальное распределение Лурии и Дельбрюка, названное так в честь тех людей, которые решили загадку о том, как же возникают мутации у бактерий. Вы можете на это смотреть таким образом: если в случае ламарковского механизма мутации возникают как бы одномерно, в самый последний момент, то в случае дарвиновского механизма вы как бы добавляете еще одно измерение, вы должны учитывать время, историю. При раннем возникновении устойчивой клетки она вносит непропорционально большой вклад в общее количество устойчивых колоний, которые вы обнаруживаете в конце эксперимента. Итак, дарвиновское распределение будет гораздо менее равномерным, чем ламарковское, и есть математика, которая позволяет строго сказать, насколько именно больш е й должна быть эта неравномерность.
|
|
|
Вопрос из зала: Можно спросить, в чашке территориально — куча колоний будет, или они все перемешиваются?
Константин Северинов: Мы растим наши клетки в жидкой культуре, и они там все равномерно перемешаны. Представьте себе, что у вас есть пробирка, в которой есть жидкая среда, и бактерии там растут, делятся. Вообще, вы очень правильный вопрос задаете, мы сейчас собственно и переходим к анализу результатов настоящего, а не мысленного эксперимента.
Итак имеется 8 пробирок с одинаковым обьемом жидкой среды, бульона, и мы посадили в каждую пробирку по 1 клетке. Мы умудрились, мы взяли нанобиоманипулятор, поймали по одной клетке за хвост и посадили их туда. А потом разрешили им делиться. Дочерние клетки, естественно, у нас в этой среде равномерно перемешались. После некоторого периода роста, все содержимое каждой пробирки мы высеяли на чашку, подобную той чашке, которую я вам показывал. При этом, так как чашка большая, а бактерий у нас немного, то каждая из бактерий окажется далеко от другой, но вокруг этих бактерий будет масса вирусов, фагов. Потому что у нас среда селективная, мы на эту чашку посадили вирусы. Все чувствительные клетки будут просто съедены вирусом. А устойчивые клетки начнут делиться, потому что им, что есть фаг, что нет — все равно, и образуют колонию. И мы будем считать просто колонии.
Вопрос из зала: То есть мы помещаем в каждой чашке понемногу, а здесь в каких-то ничего, а в каких-то есть?
Константин Северинов: Да, да, да. Это собственно то, что мы и увидим.
Эксперимент, который мы обсуждаем, был сделан двумя очень молодыми людьми, Максом Дельбрюком и Сальвадором Лурия. На этом слайде они сфотографированы в конце 40-х годов в американской лаборатории Колд Спринг Харбор, где проводились и сейчас проводятся замечательные курсы и конференции по разным биологическим темам. Дельбрюк - немец, который убежал из фашистской Германии, а Лурия - еврей, который убежал из Италии Муссолини. Они встретились в 1942 г. на конференции в Филадельфии.
|
|
|

Они работали в разных концах Соединенных Штатов, и оба интересовались проблемой природы гена и вопросами изменчивости и наследуемости признаков у бактерий. Дельбрюк был физик, биологии его в свое время якобы научил Тимофеев-Ресовский. А Лурия был очень хороший бактериолог, и он на протяжении довольно длительного времени пытался в реале делать тот опыт, который мы с вами сейчас проделывали мысленно. Но он никак не мог сделать какой-нибудь вывод из своих результатов. У него не было математического аппарата, который позволил бы ему интерпретировать данные. Он был готов к любому варианту механизма возникновения устойчивых к бактериофагу бактерий, но не мог их отличить. Ему Дельбрюк в этом помог. Их экспериментальные результаты, опубликованные в 1943 году, показаны на слайде.
Экспериментальная проверка (тест Лурии — Дельбрюка) 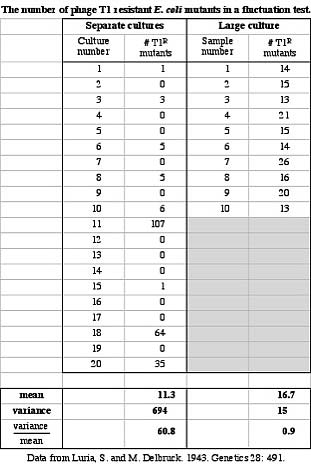
Здесь в таблице есть две колонки. В колонке слева показаны результаты, полученные с 20 отдельными культурами — 20 пробирками (culture number). В каждой пробирке был тот пресловутый 1 мл бульона, и туда было посажено небольшое количество бактерий. Бактерии росли, делились, а потом все содержимое каждой культуры высевалось на среду с фагом, и подсчитывались устойчивые колонии. И вот что вы здесь видите: есть 0 и 1 и 5 устойчивых колоний, но в некоторых культурах есть 107, 64 и 35. Наблюдаемое распределение числа устойчивых колоний характеризуется средним (оно около 11) а также дисперсией. Так вот - дисперсия здесь совершенно чудовищная, и то, что она действительно большая, показывают данные в правой части таблицы, про которые я вам не буду говорить, но в целом результат вполне строго доказывает, что ситуация соответствует дарвиновскому механизму, а не ламарковскому. Т.е. у бактерий есть изменчивость, которая наследуема, которая возникает спонтанно, и при отборе происходит выживание вариантов, приспособленных с измененным условием окружающей среды. С другой стороны, результат также показывает, что, по-видимому, у бактерий нет способности адаптивно отвечать на изменения окружающей среды путем приобретения полезных для них признаков. Если бы это было, мы бы имели пуассоновское распределение числа устойчивых колоний между культурами.
Вопрос из зала: То есть в каждой пробирке что-то было бы?
Константин Северинов: Да, мы как раз это и видим в правой колонке таблицы. Там показано вот что: 10 раз высевалось по одному о тому количеству культуры из одной общей культуры. И в этом случае вы просто видите чисто статистическую разницу в количестве колоний на разных чашках.
Вопрос из зала: Скажите, а здесь зафиксировано ожидаемое значение устойчивых — 11 или 16?
Константин Северинов: Это не ожидаемые, это определенные в эксперименте средние значения, т.е. мы взяли 20 чисел в левой колонке, сложили и поделили на 20. И то же самое проделали с 10 числами в правой колонке. Видно, что у вас значения средних в обеих колонках близкие, а значения дисперсии отличаются очень сильно.
В биологии есть одно интересное свойство: почти все ответы можно получить очень простыми методами, особенно, если знаешь, что ищешь. После того, как ответ был получен с привлечением математики, которая для большинства нормальных биологов неродная, они сказали: ну конечно же! - и сделали вот такой простейший опыт, который показывает то же самое, что и опыт Лурии-Дельбрюка. Представим, что у нас есть чашка Петри, показанная на слайде. Эта чашка Петри очень густо засеяна чувствительными к бактериофагу бактериями, мы даже не видим отдельных бактерий, они образуют сплошной газон. Допустим, что на этой чашке спонтанно, с определенной частотой, возникли устойчивые к вирусу клетки. Их потомство в этом бактериальном газоне присутствует, но мы, конечно, его не видим. Давайте найдем способ их увидеть. Возьмем такую специальную “высокотехнологическую” штуку, которая называется “перепечатка” — это такая кругляха, соответствующая по диаметру нашей чашке, и на нее натянут бархат, к которому хорошо прилипают бактерии. Вот мы этим штампом возьмем и коснемся нашего бактериального газона и перепечатаем бактерии, задержавшиеся на бархате, не на одну, а сразу на 3 чашки, засеянные вирусом. На всех трех чашках возникнут устойчивые колонии и относительное расположение этих устойчивых колоний на всех трех чашках будет одинаково.
Доказательство спонтанной природы мутаций методом перепечатков

О чем это говорит? Говорит ли результат о том, что у нас скорее дарвиновский механизм? Да, потому что идентичность паттерна устойчивых колоний означает, что устойчивые бактерии пресуществовали на исходной чашке. Мы их просто отобрали с помощью бактериофага. Т.е. наш бактериальный газон - это такой бактериальный “город” или “страна”, в которой есть масса мутантов или, если хотите, индивидуальностей. Мы о них ничего не знаем, но мы можем их отобрать. Если бы у нас ламарковский механизм, если бы бактерии отвечали на изменение условий путем приобретения устойчивости, в нашем случае - к вирусу, у нас паттерн устойчивых колоний на разных чашках был бы разный, а этого не происходит. И никакой математики не надо. Результатом этих экспериментов стало то, что люди навыделяли огромное количество разных мутаций в разных генах кишечной палочки, которая на сегодня является наиболее изученным и излюбленным модельным организмом для молекулярных биологов и микробиологов. Ученые смогли “разделить” ген, оказалось, что можно получать множественные мутации в одном и том же гене, изучать их отношение друг к другу. В конце концов, в результате этой работы было сформулирована “Центральная догма молекулярной биологии”, которая утверждает, что в последовательности ДНК закодирована генетическая информация, ДНК может реплицироваться с сохранением этой информации, но при этом возможны ошибки, однако происходят они не так часто, и ошибки эти - и есть мутации, частота встречаемости которых в популяции зависит от отбора. Информация, которая находится в ДНК, копируется в РНК специальными ферментами под названием РНК-полимеразы, а затем РНК транслируется машиной под названием рибосома в белок. Белок, его активность определяет признаки, которые мы с вами можем видеть: цвет глаз, цвет кожи, вьющиеся или невьющиеся волосы - в случае людей и т.д. В общем, центральная догма полностью соответствует дарвиновскому механизму наследования, эволюции. У нас есть ДНК — депозитарий информации, которaя копируется и передается от поколения к поколению, но копируется с какой-то небольшой вероятностью случайных ошибок. Эти ошибки, которые суть просто изменения в последовательности оснований ДНК, создают изменчивость. Изменчивость проявляет себя в измененной функции белков, что приводит к измененным свойствам организма, на который действует отбор. И никакого ламаркизма здесь нет. Ламаркизм предполагал бы, что есть обратный поток информации от внешней среды на белок, а затем на РНК к ДНК. На сегодняшний день такие механизмы не известны. Результатом развития всех этих представлений стал великий синтез, “неодарвинизм”, который сочетает в себе положения классической генетики, молекулярной биологии и генетики и, собственно, исходных дарвиновских постулатов.
Давайте теперь повторим эксперимент. На слайде помещена фотография, сделанная в Колд Спринг Харборе в начале 70-х. Вы видете постаревшего Сальву Лурию и Джона Кернса. Джон Кернс — это один из крупнейших исследователей ранней молекулярной биологии, связанной с изучением бактерий и их вирусов. В Колд Спринг Харборе собирается масса народа, они выпивают и беседуют друг с другом на разные научные темы. Показанные на фотографии два крупных ученых не гнушаются поговорить с аспирантом, который, кстати, сейчас тоже очень известный исследователь. Это все часть атмосферы Колд Спринг Харбора, которая делает его Меккой современной науки о жизни. Джон Кернс находясь уже в почтенном возрасте (ему было далеко за 60), опубликовал в конце 80-х годов в журнале “Nature” статью, которая называлась “О природе мутаций”. На слайде приведен “Abstract” этой статьи, в котором написано, что “нуклеиновые кислоты реплицируются с очень большой точностью. Однако, иногда в их последовательности происходят изменения, которые мы называем “мутации”, и эти изменения генерируют изменчивость, которая позволяет происходить эволюции.

Эта концепция была разработана в результате изучения вариаций у бактерий. На сегодняшний день (напомню, работа опубликована в 1988 году) считается, что мутации возникают постоянно и спонтанно, не в связи со своей полезностью. "В этой статье, - пишет Кернс, - мы, с одной стороны, обозреваем историю того, как возникла идея спонтанных мутаций у бактерий, а потом делаем эксперименты, которые показывают, что, возможно, клетки все-таки могут контролировать, где и как у них происходят мутации”. Здесь сказано что-то очень важное: ведь как только вы начинаете контролировать, где у вас происходят мутации, вы переходите к ламарковскому механизму. Вы - сознательно или несознательно - выбираете, какие мутации у вас должны произойти, то есть они перестают быть спонтанными. От чтения этой статьи возникает ощущение, что Кернс решил попробовать сделать опыт, который был бы еще проще, чем у Лурии и Дельбрюка, но при этом был бы не менее, а более информативен. Цель его опыта - это попытка найти адаптивные мутации. Я сразу скажу, что опыт Кернса не удался, хотя в последней части лекции я постараюсь вас убедить, что адаптивные мутации у бактерий действительно существуют. Своей статьей Кернс вызвал большой переполох. На сегодняшний день эта статья цитировалась более чем тысячу раз. Национальными институтами здоровья и Национальным научным фондом США было потрачено не менее десятка миллионов долларов в виде грантов очень хорошим ученым, чтобы разобраться, что же все-таки происходит на самом деле. Так как эволюция вызывает сильные чувства у людей не только в России, но и в Америке, было забавно наблюдать, как на экспертной панели одного из Национальных институтов здоровья один ученый обзывал другого коммунистом из-за того, что их мнения по поводу этого эксперимента не совпали. А ведь в Америке худшего оскорбления просто не бывает. Так в чем же, собственно говоря, суть этой статьи? Мы будем отбирать lac+ колонии из lac– популяции все той же самой кишечной палочки. Что это значит на человеческом языке? Оказывается, что у бактерий существует фермент, который кодируется геном lac и этот фермент, продукт гена lac, необходим для того, чтобы клетка могла использовать сахар под названием лактоза как источник пищи. Нормальные клетки дикого типа называются lac+, и они образуют колонии на средах, содержащих лактозу как единственный источник пищи. Это и понятно — раз у них есть фермент, который позволяет использовать лактозу как пищу, то они, конечно, на среде, содержащей лактозу как единственный источник пищи, живут. С другой стороны, мутантные клетки, они называются lac–, не имеют такого фермента, не способны использовать лактозу как источник пищи и поэтому на средах, содержащих лактозу как единственный источник пищи, колоний не образуют. Среда, содержащая лактозу, будет в нашем эксперименте селективной средой. Клетки обоих типов растут на специальных индикаторных средах и образуют колонии разного цвета, при этом клетки дикого типа образуют колонии синего цвета, а мутантные lac– клетки образуют колонии белого цвета. Это все, что нам необходимо знать. Вот такая у нас будет экспериментальная система.
Экспериментальная система: отбор lac+ колоний из lac- популяции

Мы возьмем популяцию lac– клеток и будем отбирать lac+ клетки. У нас не будет 20 культур, как в прошлом опыте. У нас будет только одна чашка — вот она, показана на слайде.
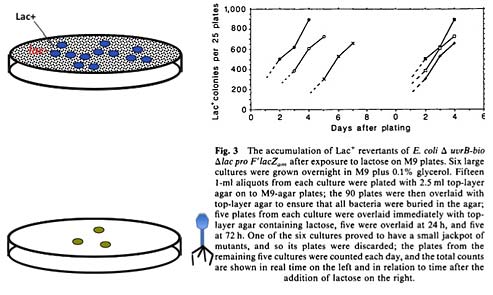
На этой чашке помещена среда с лактозой как единственным источником пищи. Теперь мы на эту чашку высеем очень много lac– клеток, которые здесь расти не должны, потому что они не могут использовать тот источник пищи, который мы им предложили. Для образования видимой глазом колонии из одной клетки-основательницы достаточно ночи, 8-10 часов. По истечении этого времени мы ожидаем увидеть некоторое количество колоний, и эти колонии по определению будут lac+. Это колонии произошли из клеток, которые “ревертировали”, т.е. перешли из исходного состояния lac– в состояние lac+. Такой опыт до Кернса делали много-много раз. Вы вечером ставите чашку, на которую вы высеяли бактерии, в термостат, а утром приходите и считаете колонии. Посчитали - и дальше что-нибудь еще делаете, а чашки выкидываете или ставите в холодильник, где бактерии больше не растут. А Кернс решил их посчитать не только на следующий день, но еще и через день, и через 2 дня, и через 3 дня. Вот и весь его опыт. В чем здесь суть? Если мы считаем, что каждая из колоний, которая выросла на селективной среде, произошла из спонтанно возникших и ранее предсуществовавших lac+ клеток, то все lac+ клетки, которые были высеяны на чашку вечером, должны были образовать колонии на следующий день. А дальше количество колоний должно оставаться постоянным. Но оказывается, что если подождать 2 дня, то возникают еще колонии, три дня — еще. И вот, собственно, в правой части слайда перед вами единственная экспериментальная картинка из статьи Кернса в “Nature”. Из графика видно, что с течением времени наблюдается линейный рост количества колоний: чем больше вы эту чашку держите в термостате, тем больше lac+ колоний возникает. И так как все, что было на чашке с самого начала, должно было вырасти уже в течение первых суток инкубации, мы вынуждены признать, что каким–то образом клетки постепенно “приучаются” или “приручаются” использовать лактозу как источник пищи. Оказывается, что это изменения наследуемы. То есть те клетки, которые выросли во второй и третий день, действительно, lac+, они могут использовать лактозу, они и их потомки теперь все время будут на лактозе расти. Заметьте, что если мы сделаем опыт по Дельбрюку, если мы высеем клетки на среду с фагом, такого не произойдет. Никаких дополнительных колоний, устойчивых к фагу, с течением времени не возникнет. Возникает вопрос: в чем разница?
Реплика из зала: Одних съели, других — нет!
Константин Северинов: На самом деле замечательно, что вы это почувствовали. Да, действительно, на чашках с фагом просто атомная война произошла. Все клетки, которые здесь не могли жить, их фаг убил — они просто исчезли. А в случае с лактозой ситуация другая — мы поместили клетки на среду без лактозы, у них нет еды, но отсутствие еды — это не смерть. По крайней мере, не быстрая смерть. Т.е. у нас здесь голодающие клетки сидят, голодают, с завистью смотрят на тех, кто начал расти с самого начала. А потом некоторые из них вдруг получают какой-то стимул, вдохновение - и тоже начинают расти...
Вопрос из зала: Голодная клетка один раз делится или может 2 раза делиться?
Константин Северинов: Она делится какое-то количество раз, но небольшое. Происходит несколько актов деления, да. Это вы в правильном направлении думаете.
Вопрос из зала: Насколько доказано, что все те клетки, которые были высеяны, действительно, lac–? Каким образом они очищаются? Быть может, там затесался lac+?
Константин Северинов: Ну, что значит “затесался”? Затесался — это все равно, что он спонтанно возник. Критерии чистоты микробиологической работы были разработаны еще Кохом в конце XIX века. Культура чистая, если она клональна, если она выделена из одной клетки. Всякая колония, выросшая на чашке, есть потомок единственной клетки. Перед высевом на чашку они у нас сразу и выросли. Те lac+ колонии, которые выросли в первый день на лактозе, ничем в принципе не отличаются от тех, которые здесь выросли на чашках с фагом. Это одно и то же. Это то, что предсуществовало и тут же пустилось в рост на соответствующих селективных средах. Потому что одним из них все равно, есть фаг или нет, а другим все равно, является ли лактоза единственным источником пищи.
Вопрос из зала: Вы хотите сказать, что два механизма присутствуют одновременно?
Константин Северинов: Это не я хочу сказать, это данные говорят. Но это не отменяет вопроса о том, каков механизм возникновения “поздних” lac+ колоний. Возможно, что колонии, возникающие на второй и на третий день, не такие, как предыдущие, у них есть что-то особенное, и такое ощущение, что клетки, которые их образуют, как-то знают, куда им двигаться. Они каким-то образом решают, что они должны стать lac+. Т.е. изменения в этих клетках адаптивны, они не предсуществуют, и, следовательно, они обязаны своим возникновением какому то ламарковскому механизму. Статья Кернса как раз и была попыткой показать, что могут быть адаптивные мутации.
Вопрос из зала: А разве те несчастные голодающие клетки, которые делятся 2-3 раза, могут образовать в результате мутаций такие колонии?
Константин Северинов: Нет, но давайте посмотрим, что происходит.
В чем разница двух опытов? В том, что в опыте Кернса клетки выживают, а в опыте с фагом — нет.
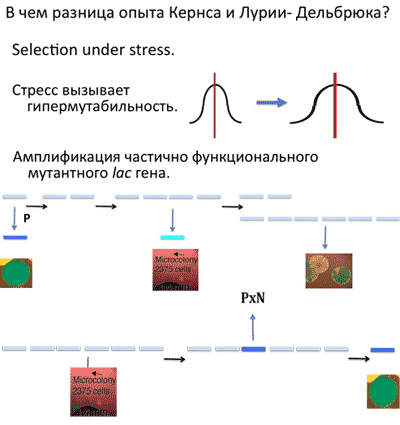
Селекция, которая производилась в опытах Кернса, по-научному называется селекцией в условиях стресса. Оказывается, что стресс, в нашем случае это голодание, вызывает гипермутабельность. Почему возникают мутации? Потому что ваша ДНК реплицируется не очень точно. Логично предположить, что если вам очень плохо, вы голодаете, но тем не менее реплицируете ДНК, то количество ошибок при репликации у вас возрастет, просто потому, что машина, которая реплицирует ДНК, начинает работать менее точно. В данной ситуации это оказывается полезным. Почему? Потому что увеличение количества ошибок увеличивает изменчивость. А увеличенная изменчивость дает дополнительный материал для отбора. Т.е. даже если исходные lac– клетки не содержали необходимых мутаций до высева на среду с лактозой, lac+ мутации могли возникнуть за счет пониженной точности репликации клеток, находящихся на разных стадиях голодания. Надо понимать, что это ненаправленный, т.е., дарвиновский процесс, в ходе которого увеличивается количество всех мутаций. Но из получающейся более разношерстной популяции можно-таки будет выбрать несколько ребят, которые стали такими, как нужно. Это первый механизм возникновения “адаптивных” кернсовских мутаций. Второй механизм называется “амплификация частично функционального мутантного lac гена”. Он более сложный. Я попытаюсь его объяснить; если я буду путаться, то вы, пожалуйста, прерывайте, а я тогда попробую еще раз. Дело в том, что опыт Кернса вовсе не такой простой, как кажется на первый взгляд. Этот опыт был сделан так, чтобы он сработал как надо. Дело в том, что тот испорченный lac ген, с которым работал Кернс, не был испорчен полностью, окончательно и бесповоротно. Продукт мутантного гена работал, но с эффективностью лишь в 2% от активности продукта lac-гена дикого типа. Ситуация схематически показана на слайде. Светло-голубая палочка обозначает испорченный lac ген; этот ген может с вероятностью P перейти в полностью функциональное состояние и, в результате, у вас образуется колония синего цвета. Помните, lac+ колонии образуют колонии синего цвета? — вот такая колония и показана на слайде. Такой переход из lac- в lac+ состояние приводит к образованию колоний, выросших в первый же день, а также колоний, образовавшихся позже за счет гипермутабельности при стрессе. Но существует и другой, более сложный процесс. Оказывается, в клетке вообще, а в особенности в конкретной экспериментальной системе, сознантельно использованной Кернсом, с определенной частотой может происходит дупликация, т.е., удвоение числа копий lac гена.
Реплика из зала: настройка!
Константин Северинов: Ну, настройка — да. На самом деле, с какой-то вероятностью любой ген клетки может дуплицироваться, то есть его может временно стать две, а не одна копия. Если происходит дупликация, то может произойти и дупликация дупликации, т.е., учетверение копийности гена. А теперь смотрите, что происходит. В обычной ситуации это не плохо и не хорошо, и у клетки есть специальные механизмы, которые следят за тем, чтобы лишние копии генов не накапливались, а удалялись. Если у вас есть сильно, но не до конца испорченная копия гена, как в случае нашего lac- гена, то если у вас станет этих копий две, то, наверное, особой разницы бактерия не почувствует. Но если у вас будет четыре копии, то четыре вот таких испорченных “Запорожца” хоть и не сделают “Мерседес”, но клетка почувствует себя несколько лучше, ведь четыре копии обеспечат 8% (2% х 4) от нормальной активности. И такой уровень активности может позволить клетке делиться не один или два раза, как вот кто-то сказал, а больше, и с течением времени образовать крохотную маленькую колонию на селективной среде с лактозой. Вот на слайде показана такая микроколония, сфотографированная в микроскоп, в которой находится 2375 клеток. А рядом для сравнения показана нормальная колония, видимая невооруженным глазом. А микроколония еле-еле растет на среде с лактозой, потому что низкий уровень активности lac-фермента едва позволяет клеткам существовать. Дальше происходит вот что - когда у вас клетка микроколонии делится, то в каждой дочерней колонии должны быть, естественно, четыре копии мутантного гена. Однако, множественные повторы нестабильны, и при делении может происходить явление, называемое сегрегацией, в результате которой может возникнуть ситуация, когда у дочерней клетки стало две копии мутантого гена, а у другой — целых шесть! А шесть плохих копий гена - это уже почти хорошо, такие клетки начинают расти на селективной среде быстрее родительских. Процесс такой амплификации и селекции все более быстрорастущих бактерий может повторятся внутри растущей микроколонии несколько раз. В результате возникают вот такие, так называемые, секторные колонии. На индикаторной среде с лактозой они не белые, и не голубые, а какие-то пятнистые. Понятно, что сам по себе процесс амплификации с последующей селекцией быстрорастущих клеток внутри колонии полностью дарвиновский, но он занимает какое-то количество времени, так как он связан с этим муторным периодом медленного роста. В конце концов происходит еще одна вещь. Как мы помним, вероятность перехода из состояния lac- в состояние lac+ равна Р. Но если в результате амплификации у нас увеличилось количество копий lac- гена на клетку, то общая вероятность получения нормальной копии гена увеличивается пропорционально степени амплификации.
Вопрос из зала: Хоть одной копии?
Константин Северинов: Хоть одной. А дальше идет дарвиновский же процесс селекции против лишних плохо функционирующих копий. Если у вас есть одна нормальная копия, которая обеспечивает вам безбедное существование, то весь этот лишний груз, возникший в результате более ранней амплификации, очень быстро выкидывается за счет действия специальных молекулярных машин клетки. И вы очень быстро переходите в обычное lac+ состояние с одной копией нормального гена и образуете большую синюю колонию, которая “не помнит” про все те ужасы, через которые ей пришлось пройти, когда она была еще маленькой. Потребовалось около 15 лет работы очень хороших ученых, чтобы все это исследовать, понять, как это происходит на молекулярном уровне, и разобраться, что именно происходит в опыте Кернса.
Вопрос из зала: Получается, что нет ламарковского механизма?
Константин Северинов: Ну подождите, у меня 3 части. Но здесь ламарковского механизма нет.
Вопрос из зала: Я именно про этот сегмент и говорил.
Константин Северинов: Ну да, здесь нет... Зачем я вам все это рассказываю? Почему мы это должны знать, и, вообще, зачем этим заниматься? Интересно, что исследования кернсовских мутаций активно поддерживал Национальный институт рака. Более того, Кернс сам работает в Гарварде в департаменте раковой биологии. Причем здесь рак? Оказывается, что вот эти два процесса, которые я вам описал, гипермутация и амплификация отдельных генов у бактерий, тождественны тем процессам, с которыми многие из нас, к сожалению, когда-нибудь в своей жизни столкнутся, а именно процессам роста злокачественных опухолей. Возникновение опухолей - это многоступенчатый процесс, в результате которого происходит амплификация определенных генов, а также накопление новых мутаций за счет гипермутабельности. Связано это с тем, что маленьким раковым опухолям очень плохо: клетки в них голодают, специальные системы в организме с ними борются, иногда их еще лекарствами травят. Маленькая опухоль похожа на микроколонию, про которую мы только что говорили. А процесс происхождения крупной опухоли с развитием всего того, что доставляет нам массу неприятностей, происходит на молекулярном уровне по тем же принципам, что у lac- бактерий на среде с лактозой, только роль lac- клетки играет переродившаяся раковая клетка, а неблагоприятной средой является наш организм. В сущности, равитие опухоли — адаптивно. И увеличение злокачественности опухоли тоже адаптивно, с точки зрения опухоли, по крайней мере.
Теперь я перехожу к заключительной стадии, в ходе которой я постараюсь показать, что дело Ламарка живет и побеждает. Дельбрюк и Лурия показали, что это не так. Потом у нас был момент, когда мы думали, что есть таки ламарковский механизм, но это была лишь видимость. Теперь мы займемся изучением специальной системы, которая называется CRISPR/Cas. Открыта эта система была лет 20 назад, и вплоть до 2005-го года никто знать не знал, зачем она нужна. Тем не менее, такая система есть почти у всех бактерий. CRISPR/Cas локус (локус - это у генетиков место на хромосоме) имеет следующую структуру. Он состоит из участка ДНК, называемого CRISPR-кассетой, устройство которого показано на слайде. Имеется набор идентичных по последовательности повторов — они показаны ромбиками. В кассете, показанной на слайде, есть 30 ромбиков-повторов, каждый из которых имеет длину 30 нуклеотидных пар или три витка спирали ДНК. Между повторами находятся спейсеры, они все одинаковой длины, но разные по последовательности и показаны квадратиками. Рядом с CRISPR-кассетой, как правило, находятся специальные гены, их очень успешно изучал наш соотечественник Женя Кунин в Национальных Институтах Здоровья, эти гены называются Cas. Все, что было известно про эти гены до недавних пор, - это то, что про них ничего не известно. Они ни на что не похожи, но они почти всегда есть рядом с CRISPR-кассетами. Незнание функции чего-либо совершенно не является препятствием для его практического использования, часто даже наоборот. CRISPR/Cas является отличной иллюстрацией этого утверждения. Есть такая компания DANISCO — это крупная международная компания, которая занимается производством стартовых культур для молочной промышленности: сыр, йогурт, простокваша, очень много того, что мы едим, сделано с помощью стартовых культур, которые специалисты DANISCO разработали. Когда промышленник покупает у DANISCO бактерии и кладет их в большой чан с молоком, там начинается процесс брожения, в результате которого должен образоваться определенный молочный продукт. Понятно, что нужно уметь различать бактерии друг от друга. Для того, чтобы вместо рокфора у вас не получился чеддер. Но есть проблема. Иногда, когда вы устраиваете ферментацию на фабрике, делаете какой то сыр, вдруг откуда-то, буквально из воздуха прилетает бактериофаг и съедает всех ваших бактерий. И вы вынуждены все свое недобродившее молоко вылить, и понесете грандиозные убытки. На следующем слайде показана структура CRISPR-кассет различных промышленных штаммов бактерии Streptococcus thermophilus, с помощью которой деляют различные молочные продукты.
Система CRISPR/Cas
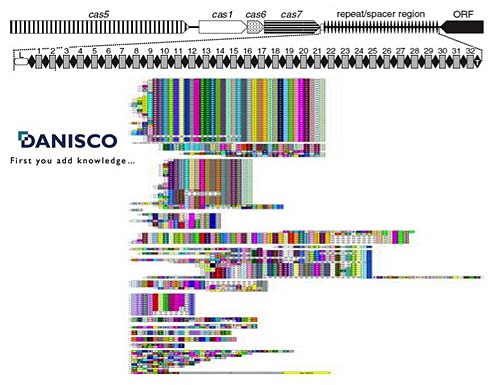
Видно, что у всех штаммов повторы одинаковые, а наборы спейсеров (индивидуальные спейсеры показаны разными цветами, при этом одинаковый цвет соответствует одинаковым спейсерам) очень разные, индивидуальные для каждого штамма. Иными словами, по данному локусу наблюдается грандиозная внутривидовая изменчивость: бактерия одна и та же, а CRISPR-кассеты у разных штаммов совсем разные. Это полезно, потому что это может быть использовано, чтобы надежно идентифицировать (иногда говорят “типировать") бактерии и отличать тех, которые делают рокфор, от тех, которые делают чеддер. Кроме того, если вы продали кому-то бактерию, которая делает рокфор, а потом узнали, что где-то в другой стране кто-то занялся своим производством рокфора, вы можете пойти туда, взять их бактерию и сказать: “Ага! А у вас набор спейсеров точно такой же, как у нас, мы считаем, что вы присвоили наш штамм!” Т.е. эта информация используется для патентования штаммов, что в принципе тоже очень полезная вещь. У нас в стране вариабельность CRISPR-спейсеров широко используется для типирования бактерий, вызывающих туберкулез.
Сейчас я рассажу в третий раз об эксперименте по селекции бактериальных мутантов. Этот эксперимент делали два ученых из DANISCO, Рудольф Барангу и Филипп Хорват. Они занамались скучнейшим делом, которым в современной университетской лаборатории никто бы им заниматься не дал. Они отбирали мутации устойчивости к бактериофагу у разных штаммов Streptococcus thermophilus.
Роль CRISPR/Cas в устойчивости бактерий к фагам

Понятно, что они это делали по причине острой производственной необходимости. Им нужно было найти такие бактерии, которые были бы устойчивы к фагам, но продолжали бы делать рокфор со всеми присущими ему вкусовыми качествами. Задачу эту они решили. По ходу дела они опубликовали несколько статей в самых лучших научных журналах мира и, кроме того, создали новый биотехнологический продукт, который сейчас уже выходит на рынок. Все это было сделано в течение трех лет. В сущности, они просто повторяли опыт Лурии-Дельбрюка, но только вариации их совсем не интересовали. Они просто брали бактерии, только Streptococcus thermophilus, а не кишечную палочку E. coli, и высевали их на чашку с фагами, а фаги были те, которые обнаруживались на “проблемных” молокозаводах и сыроварнях. Большинство бактерий, естественно, умирали, но вырастало некоторое количество устойчивых клеток. Предполагалось, что стартовые культуры, полученные на основе этих устойчивых клеток, можно будет использовать в промышленности и решить проблемы заражения бактериофагами. Но ученые DANISCO также хотели определить природу устойчивости бактерий к фагам, Помните, когда мы говорили про Е. coli, я сказал, что самый обычный механизм устойчивости - это когда вирус просто перестает узнавать бактерию, потому что поверхностные рецепторы на бактерии изменились. В случае с фагоустойчивыми мутантами Streptococcus thermophilus с этим все было совершенно нормально, т.е. вирусы с устойчивыми клетками (их называют Bim) совершенно замечательно связывались. Но вирусного потомства не возникало, и клетки жили. В чем же дело? Оказалась, что в Bim клетках CRISPR-кассета была изменена. А именно, в их CRISPR-кассетах произошло добавление одного повтора и одного спейсера. Самое замечательное было то, что для каждого нового спейсера (напомню - это участок ДНК длиной 30 нуклеотидов, три поворота спирали) обнаруживался идентичный участок в геноме того вируса, к которому приобреталась устойчивость. Что это значит?
Реплика из зала: Что клетка уже заражена.
Константин Северинов: Смотрите - вирус, конечно, маленький, но не такой маленький. Генетическая информация этого фага состоит из линейной молекулы ДНК длиной 40 тысяч пар нуклеотидов. А нас в BIM-ах добавился участок длиной лишь 30 нуклеотидов, но зато полностью соответствующий какому то участку вирусной ДНК.
Вопрос из зала: Для вируса он свой?
Константин Северинов: Кто свой?
Вопрос из зала: Вот этот мутант. Родной.
Константин Северинов: А что это значит? Вот опять же, если смотреть на данные и не переинтерпретировать их, имеющееся наблюдение говорит о том, что у устойчивых клонов происходит экспансия CRISPR-кассеты за счет включения участка генома соответствующего вируса.
Вопрос из зала: То есть я вас правильно понимаю, что это для защиты?
Константин Северинов: Я не знаю. Пока что я вам просто рассказываю об экспериментальном факте.
Вопрос из зала: Она заменяется там? Она удлиняется?
Константин Северинов: Нет, не заменяется, удлиняется. Вообще, отмеченная корреляция интересна, но не более того, пока вы не сделаете эксперимент, который сотрудники DANISCO сделали и опубликовали свои результаты в журнале “Science”. Эксперимент заключается вот в чем. Мы берем чувствительную к фагу клетку, генноинженерными способами направленно помещаем дополнительный участок ДНК, соответствующий геному вируса, в CRISPR-кассету - и смотрим, что произойдет. Стала ли клетка устойчивой к вирусу или нет. Оказывается, она действительно становится устойчивой!
Вопрос из зала: Любой участок вирусной ДНК или определенный?
Константин Северинов: Вообще говоря, не любой, но многие. Изо всего из этого возникает возникают два интересных вопроса. Первый — как происходит добавление спейсера в CRISPR-кассету зараженной клетки, ведь клетка должна быть заражена, чтобы она могла захватить участок фаговой ДНК? И второй вопрос — каким образом новый спейсер придает устойчивость к вирусу? На эту тему пока что почти ничего не известно. Понятно, что фрагмент вирусной ДНК, который станет спейсером, должен как то быть вырезан и каким то образом встроен в кассету. Происходит это с помощью продуктов тех самых Cas-генов, про которые никто ничего не знает. Эта первичная стадия приобретения спейсера называется адаптацией, ее сейчас очень активно изучают, но кроме того, что я вам сказал, ничего не известно. После того, как спейсер адаптирован в кассету, происходит “интерференция”, процесс подавления размножения вируса. Называется это интерференцией не просто так, а по аналогии с процессом РНК-интерференции, который был открыт в 1999 году. Это исключительно важный процесс в клетках высших организмов, о существовании которого никто раньше не подозревал.
Роль CRISPR/Cas в устойчивости бактерий к фагам
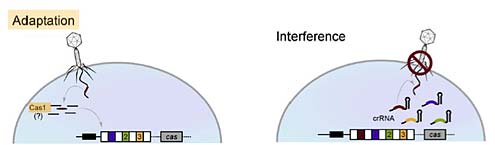
Первооткрыватели РНК-интерференции уже получили нобелевскую премию. Суть РНК-интерференции в следующем: если в клетке появился маленький участок рибонуклеиновой кислоты, который точно соответствует какому-то гену, то активность этого гена подавляется. Как это происходит, нам сейчас не важно, в этой области активно ведутся исследования, разрабатываются новые лекарства и т.д. Оказалось, что с CRISPR-кассеты делается РНК-копия, которая нарезается на маленькие участки РНК, и каждая такая маленькая РНК состоит из из полного спейсера и обрамляющих фрагментов повторов. И вот - если спейсерный участок такой короткой РНК полностью соответствует ДНК вируса, то заражение не происходит. Происходит интерференция. Непонятно, какой механизм, но так происходит.
Вопрос из зала: Получается, что та ДНК, которая приходит из вируса, не встраивается в геном клетки?
Константин Северинов: Что происходит, непонятно. Все, что мы знаем, - что клетка выживает. Если у вас происходит обычный процесс инфекции, то эта клетка обречена, она умрет.
Вопрос из зала: То есть он встраивает свой геном?
Константин Северинов: Он ничего не встраивает. Он просто вводит свой геном в клетку во время инфекции.
.
Вопрос из зала: Вирус начинает размножаться, а тут он блокирует все механизмы.
Константин Северинов: Это вы описываете то, что произошло, но как оно блокируется — непонятно. Инфекция блокируется непонятно, на какой стадии. Известно, что есть такие маленькие молекулы РНК из CRISPR-кассеты, и без них ничего не будет. Также известно, что если у вас есть полное соответствие между маленькой молекулой РНК и участком генома вируса, то заражения не будет. Все. Больше ничего не известно.
Вопрос из зала: А в каком смысле вы употребляете слово молекула — это действительно молекула или это образное выражение?
Константин Северинов: Это в том смысле, в котором фрагмент рибонуклеиновой кислоты (РНК) длиной 60 нуклеотидов является молекулой. Цепочка нуклеотидов РНК.
Вопрос из зала: Это похоже на механизм прививки?
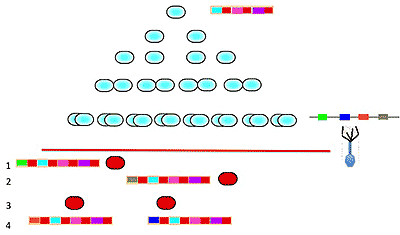
Константин Северинов: Это называется адаптивной иммунностью. Это похоже на возникновение разнообразия лимфоцитов в нашей иммунной системе. CRISPR-имунность не изучена, но понятно, что ее можно использовать самыми интересными способами, я об этом еще скажу. Для нас важно, что этот механизм сугубо, полностью 100% ламарковский. Давайте опять проведем наш мысленный эксперимент. Вот у нас есть наша бактерия, вот у нее есть CRISPR-кассета. Наша клетка поделилась 4 раза, возникло 16 клеток, и мы к этой культуре добавили фаг, а у фага есть геном, содержащий участки, помеченные зеленым цветом, синим, рыжим и оливковым. А у бактерий таких участков в геноме нет. Они их могут взять только из этого вируса. В первом опыте у нас возникла одна устойчивая колония и оказывается, что в CRISPR-кассете клеток, ее образовавших, появился спейсер, соответствующий зеленому участку. Во втором опыте у нас возникла устойчивая колония из клеток с оливковым участком. В третьем бактерии с синим и рыжим участками появились, а в четвертом устойчивых клеток не возникло. Мы можем провести тест Лурии-Дельбрюка, так же, как они делали в 43-м году. Все, что у нас сменилось, — это организм. До этого у нас была кишечная палочка, а теперь у нас Streptococcus thermophilus. Мы можем сделать отпечатки с бархатным штампом. Что бы мы ни делали, результат будет полностью обратным тому, о котором я вам рассказывал вначале. Т.е. механизм совершенно ламарковский: приобретение признаков при изменении условий окружающей среды. Он другим и не может быть, потому что изменяющаяся среда в виде вируса и является источником информации о том, как с этим изменением бороться.
Устойчивость, вызванная CRISPR/Cas, чисто адаптивна (приобретение признаков наследуемых признаков под действием окружающей среды)!
Вы можете мне сказать: ну подумаешь, люди 60 лет после Лурии и Дельбрюка знать не знали про этот механизм, и ничего. Но это, наверное, неправильный взгляд на вещи. Дело в том, что CRISPR-системы очень широко распространены. Они есть у 100% архей, такие есть удивительные бактерии, и более чем у 50% бактерий. У большинства бактерий CRISPR-локусы гипервариабельны, т.е. набор спейсеров у близкородственных штаммов одного и того же вида очень-очень разный. Хотя все остальные части генома этих бактерий одинаковы. CRISPR-локусы - самые быстро эволюционирующие, в эволюционном смысле - самые активные участки генома бактерий. И занимаются они этой своей эволюцией чисто по Ламарку.
В наши дни увлечение библиометрией привело к тому, что интерес к области измеряется количеством публикаций на эту тему. Рост количества публикаций по CRISPR-системам взрывообразен, и есть какие-то специальные критерии, которые показывают, что это одна из самых горячих тем, которые существуют в современной микробиологии. А светлое будущее CRISPR-систем (ламаркизма) показано на следующем слайде, где отражены направления будущих исследований.
Светлое будущее ламаркизма

Безусловно, очень интересен молекулярный механизм: как происходит накопление спейсеров, как происходит сама интерференция? За этим скрыта какая-то очень интересная молекулярная биология, которую мы сейчас совсем не понимаем. Это тот механизм, который обеспечивает ламарковское наследование в этом конкретном локусе. Другое направление - это типирование, это то, что я вам говорил, что с помощью разнообразия CRISPR-кассет можно разделять и идентифицировать штаммы. Отличать штаммы более патогенные от менее патогенных, тех, которые деляют рокфор, от тех, которые делают чеддер, и так далее. Можно направленно создавать штаммы с фаговой устойчивостью, отбирать или конструировать штаммы, в которых в CRISPR-кассету введен дополнительный спейсер, который обеспечивает устойчивость к тому или иному фагу. В частности, DANISCO уже вывела на европейский рынок продукт под названием Криспекс — это йогурты, полученные с помощью сконструированных штаммов, устойчивых ко всем известным вирусам Streptococcus thermophilus. CRISPR-кассетa у этих штаммов содержит спейсеры, сответствующие всем известным фагам. Очень интересное направление, связанное с метогеномикой. Анализ CRISPR-кассет позволяет нам смотреть на историю бактерий. У бактерий нет палеонтологии, они не сохраняются, а информация, заключенная в CRISPR-кассетах, — это в некотором смысле взгляд в прошлое бактерий. Потому что все новые спейсеры приобретаются с одного конца кассеты, а старые спейсеры — это то, что было приобретено раньше.
В качестве вывода на этом последнем слайде приведена цитата из "Фауста". Самое главное здесь - это фраза “что невозможно, то и вероятно”.

Работы по CRISPR-системам показали, что то, что считалось невероятным на протяжении последних 60 лет, на самом деле является очень распространенным способом, обеспечивающим изменчивость бактерий. Приведенная цитата взята мной из книги “Непостоянство генома”, которую написал Р. В. Хесин. Хесин — выдающийся наш ученый, молекулярный биолог, который по складу своего характера и по методам исследования был похож на тех людей, про которых я вам сегодня говорил. Он работал в тяжелых условиях, и его работа зависела от того, как работает его голова. Очень важно уметь ставить чистые, красивые эксперименты и не бояться неожиданных результатов. Эксперименты, о которых я сегодня говорил, простые и не требуют специального оборудования, но требует специальных людей и условий. Условий, когда математики могут говорить с биологами, когда можно свободно ездить на конференции, ну и так далее. Следующий, довольно странный вывод из того, что я вам рассказал, - это то, что повторение одного и того же эксперимента может приводить к диаметрально противоположным результатам и выводам. Это может означать, что в биологии общих принципов нет, и при смене системы можно получить новый результат.
Вопрос из зала: Общий смысл экспериментирования?
Константин Северинов: Общий принцип эксперимента как раз должен сохраняться. Но результат, который вы получите при использовании разных организмов, может быть совершенно разным. Эксперимент по выявлению роли CRISPR-систем ничем не отличается от эксперимента Лурии-Дельбрюка. Все что изменилось, - это бактерии. На свете есть огромное количество разных бактерий. При этом в лаборатории удается культивировать менее чем 0,1% всех существующих бактерий. Гигантское микробное разнообразие наверняка содержит в себе массу всяких механизмов — невозможных, невероятных, но существующих. А мы про них ничего не знаем и даже помыслить о них не можем. И такие простые дихотомии, типа ламарковской и дарвиновской, неправильные, они не отражают всего разнообразия сущего. Теперь мы знаем, что ламарковский механизм наследственности есть, но это никоим образом не привело к перечеркиванию данных о существовании дарвиновского механизма, в реальности которого нет никаких сомнений. Просто, наше понимание жизни стало более полным. Считается, что в политике дарвинизм исповедуется консерваторами, а ламаркизм якобы ближе либералам. На самом деле, тут происходит подмена понятий, политические пристрастия и решения, конечно, не имеют никакого отношения к механизму эволюции. Те этические или моральные принципы, которые постоянно примешиваются к обсуждению вопроса о механизме эволюции, как у того человека, с е-мейла которого я начал лекцию, просто не имеют отношения к обсуждаемому вопросу. То, что в природе существует тот или другой механизм (а как мы теперь знаем, на самом деле сосуществуют оба), никак не влияет на то, как вы относитесь к своим ближним. Еще один интересный тезис, который я хотел бы упомянуть в качестве вывода, - это то, что, да, действительно, исследования в частных компаниях могут приводить к фундаментальным открытиям и совершенно замечательным работам. Причем, как ни странно, в истории, которую я вам рассказал, речь шла не о какой-то супер-передовой компании, способной проводить исследования, которые невозможно делать в университете, а совсем наоборот. Ведь ученые DANISCO повторяли зады, делали опыты, которые были скучными и неинтересными с точки зрени фундаментальных ученых. Но не было счастья, да несчастье помогло. Изучая “неинтересную” и старомодную устойчивость бактерий к вирусам, они получили замечательные результаты, имеющие общенаучное значение. Я все сказал, спасибо большое.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 626; Нарушение авторских прав?; Мы поможем в написании вашей работы!