
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Третий закон термодинамики
|
|
|
|
Долгие годы считалось, что в термодинамике существует два закона. Позднее было введено нулевое начало термодинамики, а затем и третий закон термодинамики. Третий закон термодинамики был сформулирован В. Нерстом в 1912 году: абсолютный нуль температур недостижим, к нему лишь можно приближаться. Этот закон описывает поведение вещества при стремлении его температуры к абсолютному нулю.
На пальцах понятно, что если мы желаем получить высокий вакуум, то мы должны откачивать из сосуда воздух. Когда в нем останется очень мало движущихся атомов или молекул, то само понятие температуры будет терять смысл. Трудно, например, сказать какова точно температура в космическом пространстве.
Теоретически вещество при абсолютном нуле выглядело бы так: все виды вещества, кроме гелия находились бы в твердом состоянии, то есть максимально упорядоченном с минимальной энтропией. Однако внутриатомное движение электронов и «нулевые колебания атомов», описываемые квантовой механикой сохранились бы и в этом случае.
В 1938 году П.Л.Капица (рис.7.11а) открыл удивительное свойство – сверхтекучесть гелия при температуре 2.20К.
В этом состоянии гелий протекал через капилляры диаметром менее 10-4 см. Кроме того, на стенках любого сосуда образуется пленка толщиной примерно сто размеров атома (по современным представлениям нано пленка), по которой сверхтекучий жидкий гелий способен самостоятельно выливаться из сосуда. Кроме того, как оказалось при этих температурах электрическое сопротивление проводника падает практически до ноля. Теорию сверхтекучести объяснил другой российский физик - Л.Д. Ландау (рис.7.11б).
а) б)


Рис.7.11. П.Л. Капица (а) и Л.Д.Ландау.
|
|
|
7.7. Термодинамические потенциалы [6]
Для решения различных задач термодинамикии анализа экспериментальных данных в физике и химии широко используются так называемые термодинамические потенциалы. Они удобны при анализе различных макроскопических характеристик состояния вещества (внутренней энергии, энтропии, объема, давления, энтропии и других). С помощью термодинамических потенциалов выражаются условия термодинамического равновесия различных веществ и критерии их устойчивости. Это позволяет вложить в некоторые производные характеристики физический смысл и рассматривать с точки зрения макропараметров системы. Казалось бы, абстрактные математические величины позволяют описать конкретные физические характеристики вещества.
Рассмотрим пример. Из определения второго начала термодинамики следует:
 . (7.7.1)
. (7.7.1)
С другой стороны, согласно первому началу термодинамики:
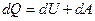 . (7.7.2)
. (7.7.2)
Из (7.7.1) и (7.7.2) следует:
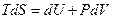 ,
,
или то, что внутренняя энергия является функцией двух параметров системы: энтропии S и объема V - U=U(S,V).
 . (7.7.3)
. (7.7.3)
Это выражение объединяет первый и второй закон термодинамики, представляя полный дифференциал внутренней энергии, как функции энтропии и объема.
Записывая выражение полного дифференциала функции U=U(S,V) переменных S и V через частные производные:
 .
.
Сравнивая это выражение с дифференциалом (7.7.3): видим, что температура и давление являются производными функциями состояния – внутренней энергии соответственно по энтропии и объему при условии постоянных значений этих величин в обратном порядке (соответственно V и S):
 (7.7.4)
(7.7.4)
 (7.7.5)
(7.7.5)
Аналогичным образом были введены и другие термодинамические потенциалы системы:
Энтальпия -  (7.7.6)
(7.7.6)
Свободная энергия -  (7.7.7)
(7.7.7)
Энергия Гиббса -  (7.7.8)
(7.7.8)
Рассмотрим примеры использования свободной энергии и энергии Гиббса для описания физико-химических процессов в живых организмах. Дифференциал свободной энергии имеет вид:
|
|
|
 .
.
Учитывая выражение (7.7.3) получим:
 , (7.7.9)
, (7.7.9)
откуда можно определить энтропию и давление, дифференцируя свободную энергию как функцию объема V и температуры T - 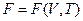 :
:
 (7.7.10)
(7.7.10)
 (7.7.11)
(7.7.11)
Как видно из выражения (7.7.9), изменение свободной энергии равно совершенной работе, совершаемой системой в изотермическом процессе (T=const):
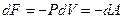 (7.7.12)
(7.7.12)
Это позволяет объяснить, например, расходование энергии теплокровными организмами. Считая их температуру неизменной, можно предположить, что работа совершается ими в результате уменьшения свободной энергии.
Энергия Гиббса описывает обмен веществом с окружающей средой при постоянном давлении и температуре, поскольку в этих условиях идут многие химические и биологические реакции, например, для теплокровных животных. Математически энергию Гиббса G=G(P,T) можно записать в виде:
 = U+PV-TS (7.7.13)
= U+PV-TS (7.7.13)
Полный дифференциал энергии Гиббса имеет вид:
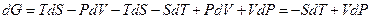 . (7.7.14)
. (7.7.14)
Сравнивая (7.7.14) с выражением для дифференциала функции G=G(P,T):
 (7.7.15)
(7.7.15)
Получаем выражения для энтропии S и объема V в частных производных:
 ,
,  (7.7.16)
(7.7.16)
Энергия Гиббса используется в расчетах энтропии и объема в изобарно-изотермических условиях. Для дифференциала энергии Гиббса вместо равенства (7.7.14) имеем:
dT=0, dP=0, dG<0.
Уменьшение энергии Гиббса происходит в изобарно-изотермическом процессе до установления равновесия, когда изменение энергии Гиббса станет равным нулю dG=0. Так, например, при охлаждении живой организм поддерживает постоянную температуру при постоянном давлении. Согласно (7.7.15) уменьшая энергию Гиббса.
Термодинамические потенциалы позволяют описать, например, изотермический, адиабатический коэффициенты сжатия, условие устойчивости, а также многие другие физические характеристики.
Контрольные вопросы к лекции №7:
1. Дайте определение теплоты, температуры и внутренней энергии. В чем различие и что общего между ними?
2. Что такое теплоемкость и удельная теплоемкость вещества? Приведите примеры.
3. Какая связь между первым началом термодинамики и законом сохранения энергии?
4. Дайте определение теплового потока?
5. Напишите уравнение теплопроводности, и объясните значение его параметров.
6. Сформулируйте первое начало термодинамики. Объясните его смысл.
|
|
|
7. Напишите первое начало термодинамики для изотермического, изохорического и изобарического процессов.
8. Дайте определение адиабатического процесса, а также его графического отличия от изотермического процесса.
9. Выведите соотношение между объемом и давлением в адиабатическом процессе.
10. Рассчитайте отношение теплоемкостей при постоянном объеме и давлении одноатомного идеального газа.
11. Тепловой двигатель и его КПД.
12. Нарисуйте схему работы теплового двигателя и холодильника.
13. Сформулируйте второе начало термодинамики. Приведите несколько формулировок второго начала термодинамики.
14. Опишите цикл Карно.
15. Дайте определение энтропии. Объясните его значение.
16. В чем смысл третьего начала термодинамики.
17. Какие термодинамические потенциалы Вы знаете. В чем их физический смысл? Приведите примеры.
18. В чем смысл энергии Гиббса?
[1] Джеймс Джоуль (1818–1889) английский физик и пивовар в 1843 году провел серию уникальных экспериментов по измерению механического эквивалента теплоты.
[2] Джеймс Джоуль (1818 -1889), английский физик. В своих знаменитых опытах в 1839 – 1843 годах измерил коэффициенты - эквиваленты тепла, механической работы и электричества.
[3] Первый тепловой двигатель был создан в 1774 году английским изобретателем Д.Уаттом. До него пароатмосферная машина была изобретена русским механиком И.И.Ползуновым. Однако машина проработала недолго, а затем была разобрана.
[4] Французская академия наук с 1775 года не принимала на рассмотрения проекты создания вечных двигателей.
[5] После смерти Л.Больцмана на его могиле выгравировали определение энтропии, введенной им как связь микро и макромира, где k – постоянная Больцмана.
[6] Термин «термодинамические потенциалы» был введен французским физиком П.Дюгем в 1884 году.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2054; Нарушение авторских прав?; Мы поможем в написании вашей работы!