
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрический ток в жидкостях
|
|
|
|
Вещества, обладающие ионной проводимостью, называют электролитами. Электрический ток в жидкостях – это упорядоченное движение ионов. Электролитами являются растворы солей, кислот, щелочей. Ионная проводимость обусловлена электролитической диссоциацией-распадом молекул на ионы под действием молекул растворителя. Образующиеся при распаде молекул ионы имеют одинаковые по модулю и противоположные по знаку заряды. Электрическое поле приводит их в упорядоченное движение.
Электролиз – выделение растворенного вещества на электродах, опущенных в электролит. Количественное описание процесса электролиза было экспериментально получено Майклом Фарадеем[6].

Рис. 9.4. Движение ионов в электролите между цинковым и медным электродами.
Первый закон Фарадея утверждает, что масса вещества, выделенная на электроде, пропорциональна заряду Q, перенесенному через электролит:
m ~ Q
m = k·Q = k·I·t, (9.2.1)
где k – электрохимический эквивалент вещества, который измеряется в системе СИ в единицах 1 кг/Кл.
В качестве примера на рис.9.4 медный и цинковый электроды помещены в серную кислоту. Под действием ионов серной кислоты в нее попадают положительно заряженные ионы цинка. При этом свободные электроны остаются на стержне. Когда цепь замкнута по внешнему проводу возникает движение свободных электронов, то есть возникает ток. Ионы цинка осаждаются на медном электроде.
Второй закон Фарадея устанавливает связь между электрохимическим эквивалентом вещества и его химическим эквивалентом. Химическим эквивалентом χ называют отношение атомной массы вещества А к его валентности n:
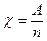 (9.2.2)
(9.2.2)
Второй закон Фарадея формулируется так: электрохимические эквиваленты вещества пропорциональны их химическим эквивалентам:
|
|
|
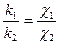 . (9.2.3)
. (9.2.3)
Из уравнения (9.2.3) следует, что отношение химического эквивалента вещества к электрохимическому эквиваленту оказывается постоянной величиной для всех веществ. Это отношение получило название постоянной Фарадея:
 . (9.2.4)
. (9.2.4)
Далее экспериментальные исследования показали, что два открытых закона являются частными случаями более общего закона - объединенного закона Фарадея.
Объединенный закон Фарадея имеет следующий вид:
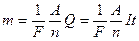 . (9.2.5)
. (9.2.5)
На принципе электролиза в электролитах работают широко используемые в повседневной жизни батарейки. Электролиз применяется в промышленности для получения водорода, гидроксидов натрия, хлора и других химических соединений, извлечения металлов из руд, а также при очистке сточных вод.
Пример. 9.2. Законы Фарадея широко используются в медицине. Организм человека состоит из биологических жидкостей, в которых много свободных электронов и ионов. Под действием электрического поля они движутся в противоположных направлениях и с разными скоростями. Электрический ток используется в физиотерапии. Постоянное напряжение ~60 вольт прикладывается к свинцовым электродам. Законы электролиза используются и для введения лекарственных веществ через кожу. Этот способ лечения получил название электрофорез. На ткань наносится лекарство. Ткань укладывается на тело человека, например, как показано на рис. 9.5, на спину.
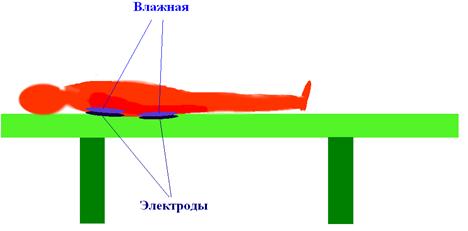
9.5. К объяснению электрофореза.
Под нее ставится электрод. Второй электрод располагается на другой части тела, например, опять же на спине. К ним подводится слабый постоянный ток, порядка десятков - сотен микроампер. Под действием тока происходит диссоциация молекул раствора, образовавшиеся ионы направляются из раствора к поверхности тела, постепенно осаживаясь на коже и проникая в нее.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 6154; Нарушение авторских прав?; Мы поможем в написании вашей работы!