КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расписание занятий
|
|
|
|
Применение II закона термодинамики в электрохимической цепи (уравнение Гиббса-Гельмгольца). Равновесие в электрохимической цепи (уравнение Нернста).
Пусть при протекании в гальваническом элементе химической реакции на каждом электроде выделяется или растворяется 1 моль-экв вещества (ионов). Заряд, который несет 1 моль-экв ионов равен числу Фарадея  Кл. Тогда количество электричества, которое несет 1 моль-экв ионов определенного вида равно
Кл. Тогда количество электричества, которое несет 1 моль-экв ионов определенного вида равно  .
.
Пусть обратимый элемент (например, элемент Даниэля-Якоби) работает самопроизвольно и обратимо. Тогда, согласно II закону термодинамики уменьшение энергии Гиббса равно максимально полезной работе:
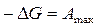
где  , т. к. процесс самопроизвольный.
, т. к. процесс самопроизвольный.
Максимально полезная работа, совершаемая элементом, равна произведению э.д.с. элемента на количество прошедшего через него электричества:
|
|
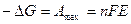 . В результате подстановки II закон термодинамики применительно к электрохимической цепи будет иметь вид:
. В результате подстановки II закон термодинамики применительно к электрохимической цепи будет иметь вид:
где n - число электронов участвующих в электрохимической реакции;
ΔG – изменение энергии Гиббса для химической реакции, протекающей в гальваническом элементе.
Производная ΔG по температуре дает значения энтропии ΔS:
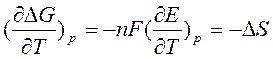
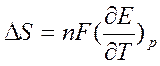
где ΔS - изменение энтропии для химической реакции, протекающей в гальваническом элементе;
 - температурный коэффициент э.д.с.
- температурный коэффициент э.д.с.
Измерив э.д.с. элемента и ее температурный коэффициент, можно найти ΔG и ΔS для суммарного процесса, протекающего в элементе.
Изменение энтальпии для химической реакции в элементе вычисляют, используя уравнение Гиббса-Гельмгольца:
| |||
|
|
|
|

Уравнение Гиббса-Гельмгольца применительно к электрохимической цепи:
|
Если  , то химическая реакция протекающая в элементе, может быть только экзотермической;
, то химическая реакция протекающая в элементе, может быть только экзотермической;
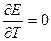 , то реакция также может быть только экзотермическая;
, то реакция также может быть только экзотермическая;
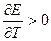 , то химическая реакция в элементе может быть как экзо-, так и эндотермической.
, то химическая реакция в элементе может быть как экзо-, так и эндотермической.
Поскольку мы рассматриваем обратимый элемент, то в определенный момент времени в нем устанавливается равновесное состояние:

Найдем связь э.д.с. такого элемента с ΔG (изобарным потенциалом) и Ка (константой равновесия реакции, протекающей в элементе). Величина ΔG связана с Ка посредством уравнения изотермы химической реакции:
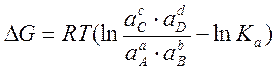
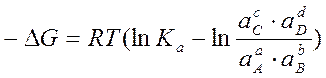
Тогда
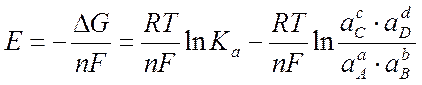
Если активности всех участников реакции равны 1 ( ), то э .д.с. элемента называется стандартной и обозначается как Е0:
), то э .д.с. элемента называется стандартной и обозначается как Е0:
|
Тогда для равновесной электрохимической цепи получаем уравнение Нернста для э.д.с. обратимого элемента:
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2082; Нарушение авторских прав?; Мы поможем в написании вашей работы!