
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вирусная инфекция как фактор прогрессивной дивергенции иммунной системы в ходе эволюции
|
|
|
|
МОЛЕКУЛЯРНАЯ ЭВОЛЮЦИЯ ИММУННОЙ СИСТЕМЫ
У высших позвоночных (рептилий, птиц, млекопитающих) эта система представляет собой целый комплекс мультигенных семейств (МС), кодирующих молекулы иммуноглобулинов (ИГ) и других ИГ-подобных иммунных рецепторов. Дифференциальная экспрессия МС и определяет принадлежность иммуннокомпетентных клеток к тому или иному функциональному типу. В целом весь этот сложный ансамбль МС функционирует так, чтобы обеспечить две основные функции иммунной системы: достаточно точное опознание и ликвидацию любого чужеродного антигена (АГ), не важно эндо- или экзогенного происхождения.
• Одним из факторов, относительно которого следует оценивать адаптивность конкретных особенностей молекулярной организации иммунной системы, являются инфекционные микроорганизмы и прежде всего вирусы и бактерии. Этот фактор относится к числу эволюционно наиболее древних, постоянно действовавших факторов
• В контексте проблемы анализа возможных селективных факторов прогрессивной эволюции (от более простой к более сложной) иммунной системы особенно интересной представляется ситуация, когда вирусы и другие инфекционные микроорганизмы (микобактерии, простейшие и т.п.) в качестве мишени поражают непосредственно клетки самой иммунной системы.
• Для иммуноцитов современных позвоночных таких инфекций известно немало: лимфоцитарный хориоменингит, полимиелит, грипп, лейкемия Френда, алеутская болезнь норок; инфекции вызванные цитомегаловирусом мышей, вирусами Денге-2, простого герпеса и т. п. Широко известен вирус — возбудитель СПИДа (AIDS). По-видимому, любая популяция или субпопуляция клеток иммунной системы может стать прямой мишенью для подобных инфекций.
|
|
|
• Математическая модель именно таких инфекций, в которых некий «обобщенный» вирус (любая внутриклеточная инфекция) поражает клетки некой эволюционно древней иммунной системы, позволяет выяснить, существуют ли (и какие) способы противостоять столь опасным для организма-хозяина инфекциям
• Модель рассматривает гипотетический предковый организм с примитивной, слабо дифференцированной иммунной системой. Предположим, что соответствующие предковые иммунные клетки (пралимфоциты) в процессе онтогенеза переходят из состояния незрелости (незрелые пралимфоциты - НП) в зрелое состояние (зрелые пралимфоциты – ЗП). Всюду в дальнейшем будем говорить о вирусных инфекциях данной иммунной системы, имея, однако, в виду, что и любые другие инфекции (см. выше) подобного рода описываются таким же образом.
• Предположим также, что вирусы способны поражать только клетки НП, т. е. незрелые пралимфоциты. Будем считать при этом, что молекулярно-генетическая система иммунитета предельно проста, а именно для адсорбции вирус использует тот самый рецептор клетки НП, которым клетки типа ЗП в свою очередь опознают и инактивируют вирусы. Адсорбция вируса на НП ведет к образованию зараженных клеток из которых путем лизиса выходят дочерние вирусы частицы. Связывание ЗП с вирусом, напротив, приводит к уничтожению вирусов.
• Эта разница в свойствах клеток ЗП и НП может быть объяснена различными способами. Например, пралимфоциты могли обладать способностью фагоцитировать вирусные частицы, но зрелые клетки разрушали их с помощью нуклеаз или/и протеаз, а в незрелых клетках соответствующие ферменты либо еще не синтезировались, либо были неактивны.
• Возможна в некотором роде обратная ситуация, когда зрелый пралимфоцит «сбрасывает» с поверхности связанный с вирусом рецептор, избегая тем самым заражения и инактивируя вирус.
|
|
|
• Данная модель описывает процессы, в общем аналогичные тем, которые происходят в тимусе млекопитающих или в бурсе птиц. И в том, и в другом органе предшественники лимфоцитов, пришедшие из костного мозга, размножаются и созревают в отсутствие антигенов. Зрелые лимфоциты секретируются наружу и заселяют периферические лимфоидные органы. Однако в целом модель не описывает современную иммунную систему высших позвоночных, а является описанием лишь тех простых систем защиты, которые могли существовать на ранних этапах эволюции.
• 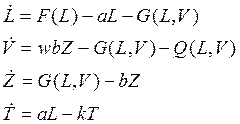 Итак, рассмотрим гипотетический предковый организм с примитивной, слабо дифференцированной иммунной системой. Обозначив символами L, V, Z, Т концентрации соответственно незрелых пралимфоцитов, вирусов, зараженных клеток и зрелых пралимфоцитов, запишем следующую систему дифференциальных уравнений динамики:
Итак, рассмотрим гипотетический предковый организм с примитивной, слабо дифференцированной иммунной системой. Обозначив символами L, V, Z, Т концентрации соответственно незрелых пралимфоцитов, вирусов, зараженных клеток и зрелых пралимфоцитов, запишем следующую систему дифференциальных уравнений динамики:
• Здесь F(L) —функция, описывающая скорость размножения незрелых пралимфоцитов. Количество локальных минимумов и максимумов не ограничено, хотя из биологических соображений наиболее правдоподобно выглядит «одногорбый» вид функции F(L). Функция G(L, V) описывает скорость заражения незрелых пралимфоцитов L вирусами V. Явный вид функции G(L, V) может быть, например, таким: G(L, V)=cLV, c >0.

Примерный вид функций F(L) и G (L, V)
• Будем анализировать устойчивость к малому возмущению особых точек систем, где все производные равны нулю. Нетривиальные точки покоя, где концентрации всех компонент положительны, не рассматриваются, поскольку отражают состояние хронической болезни, которая рано или поздно все равно кончается либо гибелью, либо выздоровлением организма-хозяина, и именно эти крайние альтернативные состояния в основном и оценивает естественный отбор.
• Система имеет полутривиальные точки покоя: I — (0,, 0, 0), — произвольное (может быть =0);
II — (, 0, 0,), где = a/k, a — корень уравнения F(L)=aL
• Первая точка соответствует состоянию «смерти» популяции пралимфоцитов в очаге инфекции, вторая – здоровому состоянию организма.
• Анализ локальной устойчивости точки I показывает, что, если в очаге заражения накопилось мало вирусов и/или они недостаточно инфекционны, а скорость размножения незрелых пралимфоцитов достаточно велика, то поступление извне в очаг инфекции новых клеток типа L позволит им размножиться и восстановить популяцию
|
|
|
• 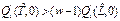 Локальная устойчивость или неустойчивость точки II системы имеет биологический смысл устойчивости или неустойчивости этой пралимфоидной ткани против малой инфекции. Естественно предположить, что организм, улучшающий свою устойчивость против инфекции, получает селективное преимущество.
Локальная устойчивость или неустойчивость точки II системы имеет биологический смысл устойчивости или неустойчивости этой пралимфоидной ткани против малой инфекции. Естественно предположить, что организм, улучшающий свою устойчивость против инфекции, получает селективное преимущество.
• Точка II устойчива, если
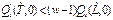 и неустойчива, если
и неустойчива, если
Случай строгого равенства не рассматривается по причине его биологической нереальности.
• Таким образом, увеличения устойчивости состояния II (фактически состояния «здоровья») можно достигнуть за счет увеличения значения QV'(, 0) и/или уменьшения значения GV'(, 0).
• Значение w зависит от вируса и, по предположению, не изменяется иммунной системой. В свою очередь усиление связывания вирусов зрелыми пралимфоцитами (QV'(, 0)) может быть достигнуто как увеличением стационарной концентрации, так и увеличением сродства рецепторов клетки Т к вирусу V. Аналогичным образом ослабить связь вирусов с незрелыми пралимфоцитами (GV'(, 0)) можно как через уменьшение стационарной концентрации, так и снизив сродство рецепторов клетки L к вирусу V
• Однако поскольку единственным источником зрелых пралимфоцитов являются незрелые, то при уменьшении будет уменьшается и. Для увеличения же необходимо увеличивать, причем как видно из рисунка, <L*, т. е. ограничено сверху
• Таким образом, в рамках данной модели единственным удачным решением проблемы стало бы приобретение рецепторов L и Т с различной авидностью к V. По сути дела это означает, что необходимо обеспечить пралимфоцитам смену АГ-специфичных рецепторов в процессе онтогенеза, причем у рецепторов, экспрессирующихся позднее, специфичность к АГ должна быть выше.
• Возможность стимулированной АГ пролиферации зрелых пралимфоцитов вывода не меняет, как показывает исследование соответственно модифицированной модели. Все приведенные выше рассуждения остаются в силе и в более сложном случае, когда вирус несет сразу несколько АГ-детерминант и соответственно защитная система пралимфоцитов способна на каждую АГ-детерминанту вируса реагировать специфичным клоном.
|
|
|
• Таким образом, к сравнительно просто организованной иммунной системе, отвечающей ранним этапам ее эволюции, предъявляются требования взаимно исключающие друг друга. С одной стороны, чем точнее будет опознаваться чужеродный (например, вирусный) АГ, тем эффективнее будет происходить инактивация этих вирусов с помощью соответствующих рецепторов пралимфоцитов, но с другой — чем эффективнее идет адсорбция вируса на пралимфоцитах-мишенях, тем больше опасность их гибели.
• Повысить устойчивость пралимфоидной системы к малой инфекции можно (в рамках указанных упрощений) двумя способами. Первый — через увеличение количества клонов пралимфоцитов, специфичных к разным АГ-детерминантам, второй — путем изменения авидности АГ-специфичного рецептора в ходе созревания пралимфоцитов.
• В рассмотренном случае рецепторы должны быть похожи друг на друга, но не слишком: похожи, чтобы зрелый пралимфоцит как можно лучше опознавал вирус, не слишком, чтобы вирус как можно хуже опознавал незрелый пралимфоцит. Второй способ представляется особенно действенным в условиях слабодифференцированной иммунной системы, способной опознавать ограниченный круг АГ-детерминант.
• Обе эти возможности были реализованы в процессе эволюции. Наличие большого числа АГ-специфичных клонов лимфоцитов у современных высших позвоночных — факт, признаваемый всеми современными теориями иммунитета. У мыши, например, насчитывается ~108 клонов В-лимфоцитов разной специфичности
• Второй способ фактически означает, что в адсорбции вирусов на иммуноцитах-мишенях и вместе с тем в опознании вирусов (вирусных АГ) с последующей их инактивацией и разрушением не могут участвовать в точности идентичные рецепторные молекулы: организм может справиться с инфекцией только тогда, когда эти функции будут выполнять гомологичные, но не идентичные ИГ-подобные белки.
• Следовательно, стратегическим решением проблемы для жертвы являются мультипликация генов ИГ-подобных рецепторов и последующая коадаптивная дивергенция соответствующих МС на новые подсемейства. В ответ вирусы вынуждены изменяться так, чтобы приобрести способность адсорбироваться на новых иммунорецепторах (и, следовательно, инфицировать новую популяцию иммунных клеток-мишеней).
• В отличие от ранее рассмотренного режима локально адаптивной, но ненаправленной молекулярной коэволюции в простых экосистемах типа «фаг — бактерия», данный вариант коэволюции представляет собой глобально направленный и адаптивный процесс прогрессивного усложнения иммунной системы.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ.
• Рассмотрим в качестве биосистемы иммунную систему и будем исходить из предположения, что любая отдельная клетка может активироваться для действий по определенной программе (для выполнения которой она и предназначена), но в отсутствие реального сигнала к активации. Будем называть это событие для краткости спонтанной активацией (СA).
• Произойти это может по многим причинам: мутация, заражение вирусом и пр. Подобная спонтанная активация представляет собой "сбой программы" и некоторым образом аналогична злокачественному перерождению клетки. Эта аналогия особенно отчетливо просматривается на примере иммунной системы, т.к. активация компетентного иммуноцита для уничтожения АГ подразумевает и его (иммуноцита) пролиферацию, т.е. ускоренное размножение
• Чтобы любая такая спонтанная активация клетки была ощутима для организма, необходимо, чтобы сложная система обладала тремя свойствами:
• 1)большое количество клеток - в системе должно быть достаточно много клеток, чтобы событие СА могло реально произойти;
• 2)усиление эффекта - система должна быть устроена таким образом, чтобы происшедшее на клеточном уровне даже единичное событие СА имело вполне ощутимые последствия на уровне организма, иначе это событие не будет замечено естественным отбором;
• 3)отсутствие эффективной отрицательной обратной связи - конечный продукт ответа на какой-либо раздражающий сигнал не должен эффективно ингибировать начальные стадии собственного синтеза.
• Рассмотрим в качестве объекта СА В-лимфоцит. Предположим, что покоящийся В-лимфоцит спонтанно (неантигенно) активировался и начал синтезировать антитела к отсутствующему реально АГ. В пользу того, что такое событие может произойти, говорит факт существования миелом - опухолей иммунной системы, при развитии которых клеточный клон В-лимфоцитов не поддается межклеточной регуляции, бесконтрольно размножается и в избытке образует специфические антитела только одного типа
• Поскольку частота злокачественного перерождения оценивается как 10-6, то можно считать, что частота спонтанной активации (СА) В-клетки в отсутствие АГ не ниже, чем 10-6. Насколько большой вред может нанести организму подобное событие?
• Если принять частоту СА В-клетки за 10-6, то в организме мыши, например, должны одновременно пролиферировать в отсутствие стимулирующеего их АГ более 200 В-лимфоцитов (что количественно эквивалентно примерно 20 клонам)
• Таким образом, если в организме мыши спонтанно активировавшиеся В-клетки дойдут до стадии плазмоклетки (синтезирующей огромное количества молекул иммуноглобулина), то их суммарный иммунный ответ "ни на что" будет таким, каким был бы ответ на примерно 20 АГ-детерминант.
• Для человека ситуация аналогичная, но, естественно, с большими количествами клеток. Ясно, что в реальных иммунных системах имеются "предохранители" от подобных нежелательных эффектов. Появление в эволюционном прошлом субпопуляции Т-хелперов могло оказаться одним из основных таких "предохранителей".

• Схема основных взаимодействий клеток иммунной системы при гуморальном иммунном ответе
• Неактивированный В-лимфоцит (обозначен В0), после встречи с антигеном (AG) и получение дополнительного сигнала от T-хелпера (Th) переходит в состояние Вμ (синтез молекул иммуноглобулина М (IgM), специфичных к AG). T-хелпер (Th) получает сигнал от AG посредством антигенпредставляющей клетки (чаще всего макрофага). Кроме того, T-хелпер (Th) помогает Вμ –лимфоциту перейти в стадию Вγ, когда происходит переключение на активный синтез иммуноглобулина G (IgG) высокоспецифичного к AG. Попутно образуются клетки памяти Вm, активирующиеся при вторичном заражении тем же AG. Из состояния Вγ лимфоцит переходит в стадию Вp – плазмоклетки или антителобразующей клетки (АОК). В этой стадии синтезируется огромное количество высокоспецифичного к AG иммуноглобулина G.
• В схеме на рисунке опущено множество деталей, поскольку для наших рассуждений существенно лишь то, что для перехода от стадии покоя к стадии АОК В-лимфоциту требуется двойной сигнал: первый непосредственно от АГ, второй - от Т-хелпера. В то же время известно, что для дифференцировки, например, эритроидной клетки- предшественника, представляющей собой не менее сложный процесс, чем антигензависимое созревание В-лимфоцита, достаточно одного сигнала, представляемого эритропоэтином.
• Однако Т-хелпер тоже получает сигнал к активации от АГ. Таким образом, сигнал фактически раздваивается: связав АГ и интернализировав его, антигенпредставляющие клетки представляет АГ-детерминанты Т-хелперу, который, активировавшись, секретирует различные лимфокины (регуляторные молекулы иммунной системы) и, тем самым, дает В-клетке дополнительный сигнал, идущий в конечном счете, от антигена же.
• Зачем нужен второй сигнал, почему бы В-клетке не проходить весь путь от стадии покоящейся клетки до АОК, проконтактировав только с АГ?
• В свете изложенных выше соображений легко увидеть, что если бы этот «oднocигнaльный», путь был реализован, то в организмах с большим количеством эффекторных лимфоцитов с широким спектром специфичностей события СА могли бы приводить к достаточно частым неприятностям.
• Приобретение в процессе эволюции системы Т-хелперов и, соответственно, необходимость дополнительного сигнала от них для последующего развития минимизируют негативные последствия для организма от случаев СА.
• Клетки-регуляторы, подавляющие иммунный ответ, не могут эффективно ингибировать спонтанно активировавшийся лимфоцит-эффектор, если они АГ- специфические, т.к. в этом случае АГ отсутствует и они не инициируются к супрессии. Если же эти клетки-регуляторы АГ- неспецифические, то они должны (как это происходит в реальных иммунных системах) ингибировать лишь конечные стадии иммунного ответа (чтобы не мешать нормальному иммунному ответу на реальный антиген) и, следовательно, не мешают и спонтанно активировавшимся лимфоцитам.
• Если мы предполагаем, что В-клетка может претерпевать СА, то такую же возможность следует предположить и для Т-хелперов. Однако, это никак существенно не влияет на ситуацию. Событие СА для Т-хелперов будет состоять в том, что клетка активируется и, в отсутствие реального АГ, начнет "помогать" переходу В0-лимфоцита в стадию Вμ и в стадию Вγ.
• Если считать действие хелперных факторов неспецифичным относительно AГ (Т-хелпер, активированный одним АГ может "помочь" В-лимфоцитам активированным другими АГ), то в случае, если две спонтанно активировавшиеся клетки - В-лимфоцит и Т-хелпер окажутся достаточно близко друг от друга, В-клетка пройдет все стадии пролиферации и дифференциации вплоть до АОК. Однако вероятность этого события пренебрежимо мала
• Если же рассматривать "помощь" Т-хелперов как специфический процесс, то вероятность того, что двалимфоцита: Т- и В-клетки с одинаковой специфичностью спонтанно активируются одновременно и окажутся рядом друг с другом, представляется совершенноничтожной.
• Всю вышеизложенную логику можно применить и к Т-клеточному иммунному ответу, где также через Т-хелперы передается второй сигнал от АГ к клеткам- предшественникам цитотоксических Т-клеток.
• Таким образом, по излагаемой гипотезе, организм, приобретший в своем эволюционном развитии иммунную систему состоящую из достаточно большого количества клеток, ставится перед фактом возможности СA своих эффекторных клеток. В этом случае приобретение подсистемы, ставящей "барьер" на пути ускоренного размножения и дифференциации СА клонов (в рассмотренном случае барьер заключается в отсутствии "помощи" от Т-хелперов) было бы явно адаптивно, поскольку минимизировало бы отрицательные последствия событий СА.
• При этом приобретение такой подсистемы стимулировалось бы свойствами самой системы - ее величиной и сложностью функционирования (при неизменных внешних условиях существования).
• Аналогичную "страховку" системы от случайных "сбоев" можно увидеть в организации нервных центров спинного мозга, т.е. центров, куда сходятся сигналы от периферийных рецепторов.
• Также "страховку" системы от случайных "сбоев" можно наблюдать и в социальных системах.
2 рис.
• Многократное превышение частоты фиксации одиночных замен по сравнению с делециями и вставками. Эта закономерность отчетливо просматривается и в эволюции других семейств белков.
• На одну делецию в реальных последовательностях приходится около 50 замен. 3 замены правдоподобнее 2-х делеций.
AEDN-R AEDNR
A-DNKR ADNKR
Ala Glu Asp Asn Arg
Ala Asp Asn Lys Arg
Адаптивное ускорение фиксации замен в эпоху выхода позвоночных животных на сушу (400-500 млн лет назад). 1 – в среднем по белку;
2 – центр контакта, α1 – β2; 3 – регуляторный центр связывания ДФГ(дифосфоглицератфосфат).

• Геном вируса гриппа, как известно, способен мутировать с исключительно высокими темпами благодаря неточностям при тиражировании своей наследственной информации. Частота нуклеотидных замен в его наследственном материале, РНК, в тысячи раз выше, чем та, что обнаружена для генома человека.

Филогенетическое дерево генов гемагглютинина H3 вируса гриппа типа А. "Висячие" вершины отвечают эпидемическим штаммам. Вблизи ветвей указаны числа синонемических/несинонемических замен.
Множественное выравнивание 17 случайно выбранных аминокислотных последовательностей внутреннего района ГА вирусов гриппа А, В, С. Звездочки обозначают аминокислоты, которые в данной позиции одинаковы во всех последовательностях. Многоточие – аминокислоты с аналогичными свойствами во всех позициях.
Филогенетические деревья, построенные для этих 17 последовательностей. Деревья построены различными методами. Около узлов – значения bootstrap показателей. Шкалы внизу – количество аминокислотных замен на сайт. Поддеревья подтипов (a) H1 и (b) H2 в филогенетическом дереве для 172 аминокислотных последовательностей внутреннего района HA вируса гриппа A. Вершины для которых оценены годы дивергенции отмечены черными кружками и буквами. Подчеркнуты человеческие и свиные последовательности, использованные для оценки скоростей и годов дивиргенции. Жирным выделены последовательности, использованные для оценки скоростей. Шкалы означают количество аминокислотных замен на сайт. Молекулярные механизмы, обеспечивающие взаимодействие вируса гриппа с клеткой-хозяином и дальнейшее его проникновение внутрь клетки, до сих пор остаются предметом многих научных исследований. Главная цель последних — помочь в разработке лекарственных препаратов, способных предотвратить инфицирование клетки вирусом. Что особенно актуально в связи с возможностью новой пандемии гриппа, причиной которой может стать мутированный штамм так называемого «птичьего» гриппа. Фактически исследуется молекулярная эволюция вируса гриппа.
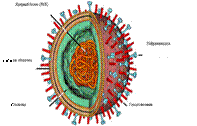
Схематичное представление вируса гриппа А. В центре вирусной частицы находится РНК, наследственный материал вируса, и ряд белков, необходимых ему на первых стадиях жизненного цикла в клетке хозяина. Гемагглютинин и нейраминидаза располагаются на поверхности вириона и отвечают за способность вируса проникать в клетку. Они же являются мишенями для B-клеточных антител, вырабатываемых иммунной системой инфицированного организма.
• Гемагглютинин и нейраминидаза отвечают за способность вирусной частицы проникать в клетку. При помощи гемагглютинина вирус прикрепляется к клетке, а фермент нейраминидаза разрушает клеточную мембрану, создавая условия для проникновения вируса внутрь клетки путем клеточного включения (эндоцитоза). Когда вирус попадает внутрь клетки, благодаря ионным каналам изменяется pH внутри вириона, что позволяет вирусу осуществить освобождение генетического материала из вирусной капсулы, предварительно проведя его подготовку.
•  Таким образом, гемагглютинин играет одну из важнейших ролей при инфицировании вирусом клетки-мишени. На поверхности вирусной оболочки гемагглютинин присутствует в виде тримеров, т.е. комплексов, состоящих из трех молекул. Каждая его молекула, в свою очередь, состоит из двух субъединиц, одна из них обеспечивает первичный контакт с клеткой, а вторая отвечает за слияние с мембраной клетки. Процесс слияния сопровождается значительными перестройками молекулы гемагглютинина, при которых высвобождается пептид слияния, спрятанный во внутренней части глобулы белка.
Таким образом, гемагглютинин играет одну из важнейших ролей при инфицировании вирусом клетки-мишени. На поверхности вирусной оболочки гемагглютинин присутствует в виде тримеров, т.е. комплексов, состоящих из трех молекул. Каждая его молекула, в свою очередь, состоит из двух субъединиц, одна из них обеспечивает первичный контакт с клеткой, а вторая отвечает за слияние с мембраной клетки. Процесс слияния сопровождается значительными перестройками молекулы гемагглютинина, при которых высвобождается пептид слияния, спрятанный во внутренней части глобулы белка.
• В вирусных белках можно выделить так называемые антигенные детерминанты — участки, с которыми предпочтительно связываются антитела. Мутации, вызывающие структурные изменения в подобных местах, т.е. меняющих форму и расположение антигенных детерминант, как раз и приводят к образованию новых вирусных штаммов. Такие вирусы становятся практически «невидимыми» для антител, уже циркулирующих в крови зараженного организма, что делает его безоружным перед нашествием вирусов.
• В отличие от других белков поверхность гемагглютинина в высокой степени обогащена местами посадки различных ионов. Еще одно не менее интересное свойство гемагглютинина — он содержит также большое число потенциальных мест такой посадки, которые могут превратиться в сайты связывания ионов в результате одиночной мутации, т.е. замены всего лишь одной аминокислоты.
• 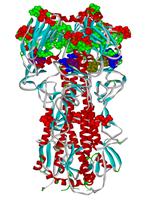 Сайты связывания различных ионов обнаруженные в пространственной структуре гемагглютинина вируса гриппа А (атомы аминокислот, формирующие сайт показаны шариками, цветом отмечены сайты связывания разных типов ионов). Благодаря этим сайтам вокруг вируса может формироваться своеобразный ионный щит, защищающий его от атак иммунной системы.
Сайты связывания различных ионов обнаруженные в пространственной структуре гемагглютинина вируса гриппа А (атомы аминокислот, формирующие сайт показаны шариками, цветом отмечены сайты связывания разных типов ионов). Благодаря этим сайтам вокруг вируса может формироваться своеобразный ионный щит, защищающий его от атак иммунной системы.
Примеры использования филогенетических методов
• Белок Р53
• Цитохромы Р450
• Прионы

• Распределение значений физико-химических различий для аминокислотных замен для филогенетического спектра гена P53. По оси абсцисс - физико-химическое расстояние между аминокислотами (по матрице Мийяты). По оси ординат - число замен, в %

• Распределение значений физико-химических различий аминокислотных замен по базе данных канцерогенных мутаций гена P53.
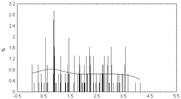
• Распределение значений физико-химических различий аминокислотных замен выявляемых при анализа псевдогенов гена P53.

• Распределение значений физико-химических различий для аминокислотных при случайных генерациях для гена P53.

• Сравнение полиномиальных аппроксимаций распределений замен по физико-химическим-свойствам для гена P53.
b - распределение для базы данных канцерогенных мутаций, p – для эволюционного мутационного спектра, ps – для мутаций в псевдогенах, r- для случайного мутационного спектра
• Распределение случайно сгенерированных мутаций в человеческом гене p53 близко к таковому в раковых клетках. Различие в средних значениях мало, но статистически значимо. Псевдогены и случайно сгенерированные последовательности того же самого состава дают существенно различающиеся распределения мутаций, особенно внутри важного ДНК-связывающего центрального участка p53.
• Полученные результаты свидетельствуют о том, что первичная структура центрального домена человеческого гена p53 имеет некоторую структурную предрасположеность к разрушающему мутагенезу. Любой из 4-х рассматриваемых спектров мутационных спектров p53 отчетливо отражает эту предрасположенность, особенно при отсутствии отрицательного давления отбора (как в p53 псевдогенах).
• Образование нового сайта связывания иона цинка в мутантном белке p53 человека, конкурирующим с нормальным сайтом за связывание цинка. Зеленым овалом отмечен нормальный сайт связывания иона цинка, красным – сформированный в результате мутации G245C.
• ЦитохромыP450 - большое суперсемейство гем-содержащих, связывающихся с мембраной белков с молекулярным весом 50 000 DA (400-530 аминокислот). В суперсемействе насчитывается более 500 членов, относящихся к 85 эу- и 20 прокариотическим видам, и около 30 псевдогенов. Цитохромы P450 участвуют в окислительном метаболизме широкого класса экзо- и эндогенных веществ (стероидов, жирных кислот, простагландинов, лекарственных веществ, канцерогенов, мутагенов, всего более 80 веществ) у бактерий, грибов, растений и животных. Большинство членов этого суперсемейства классифицируется как неспецифические монооксигеназы.
• В пределах суперсемейства наблюдается довольно значительная внутри- и межвидовая вариабельность, что обуславливает полиморфизм по особенностям метаболизма токсичных внешних агентов и большое разнообразие субстрат-специфичности цитохромов P450. Предполагается, что эволюционное приобретение такого широкого спектра субстрат-специфичности стимулируется необходимостью детоксикации разнообразных внешних химических агентов
• Цитохромы семейств CYP11, CYP17 и CYP21 имеют прямое отношение к конгенитальной адренальной гиперплазии (КАГ), которая является одним из самых частых заболеваний человека и наследуется по аутосомно- рецессивному типу. Причиной заболевания является нарушение синтеза кортизола и альдостерона с одновременным накоплением андрогенов.
• Из 5 ферментов, необходимых для синтеза кортизола из холестерина, 4 являются цитохромами (семейства 11, 17 и 21). Их гены расположены на разных хромосомах. CYP11A и CYP11B - ферменты, активные в митохондриях, 17 и 21 - микросомные. Более 90% случаев КАГ являются результатом дефицита CYP21 различной степени выраженности, основная причина остальных случаев - нарушение функции CYP11.
• У человека ген CYP21 представлен в двух копиях - активный ген (CYP21, или CYP21B) и неактивный псевдоген (CYP21P, или CYP21A). Копии имеют 98% гомологии и образуют тандемный повтор. Псевдоген имеет несколько небольших делеций и аминокислотных замен. Близость расположения гена и псевдогена приводит к большой вероятности неравного кроссинговера при мейозе и, соответственно, генной конверсии. Около 20% случаев дефицита CYP21 связано с делецией значительной части или всего гена. Большая часть оставшихся мутантных аллелей имеет небольшие делеции или вставки
• Методами многофакторного анализа показано, что мутационные спектры семейств CYP1, CYP2, CYP11 и CYP6 близки друг к другу, тогда как спектры CYP7 и CYP21 отдалены от этих четырех. Все они вместе близки к глобинам и сильно отличаются от спектра прионовых белков
• Нормальные гены CYP21 цитохромов Р450 (5 видов). Зависимость числа замен от физико-химического расстояния между аминокислотами до и после замены
• Ненормальные аллели CYP 21 цитохромов Р450 человека. Зависимость числа замен от физико-химического расстояния между аминокислотами до и после замены.
• Псевдогены CYP21 цитохромов Р450 человека. Зависимость числа замен от физико-химического расстояния между аминокислотами до и после замены.
• Полученные результаты не подтверждают распространенную гипотезу о переносе посредством генной конверсии мутаций, возникших в псевдогенах, в нормальные аллели гена CYP21, поскольку, как видно из рисунков, мутационные спектры ненормальных аллелей и псевдогенов существенно различаются: в псевдогенах слишком мало мутаций с теми параметрами, которых много в поврежденных аллелях, в частности в левом крае распределений. Скорее всего, источником мутаций в поврежденных генах могут быть нестабильные участки самого гена, а не генная конверсия с участием псевдогенов
• Согласно сушествующей гипотезе, прионовые белки существуют в двух изоформах: в виде нормального клеточного белка (обозначаемого PrPC), встраивающегося в клеточную мембрану, и в виде анормального белка (обозначаемого PrPSc), накапливающегося в мозговой ткани больных. Спектроскопический анализ PrPSc и PrPC показал, что они имеют различую конформацию: PrPC содержит»43% a-спиралей и практически не содержит b-складчатых структур, тогда как PrPSc имеет высокое содержание b-структур.
• Основываясь на некоторых экспериментальных данных, было предположено, что анормальный PrPSc каким-то образом может вызывать изменение конформации нормального PrPC, что препятствует встраиванию последнего в мембрану и способствует его накоплению в клетке


• Распределение частот встречаемости аминокислотных замен в зависимости от физико-химического расстояния между исходной и возникшей в результате замены аминокислотами. Данные для кодонов, входящих в участки Н1-Н4
• 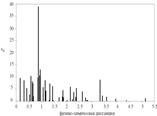 Распределение частот встречаемости аминокислотных замен в зависимости от физико-химического расстояния между исходной и возникшей в результате замены аминокислотами. Данные для части последовательности, не входящей в участки Н1-Н4.
Распределение частот встречаемости аминокислотных замен в зависимости от физико-химического расстояния между исходной и возникшей в результате замены аминокислотами. Данные для части последовательности, не входящей в участки Н1-Н4.
• Таким образом, в прионовых белках, связанных с заболеванием, наблюдается выраженная тенденция к возникновению замен, нарушающих a-спиральность. Полученные данные подтверждают предположение о том, что в основе прионовых заболеваний лежит изменение конформации PrP с разрушением a-спиралей и образованием b-структур.
•
Роль отрицательного регуляторного контура при разных видах отбора.
• Биологические системы являются открытыми неравновесными системами, которые функционируют и воспроизводятся на основе обмена с окружающей средой потоками вещества, энергии и информации. К числу фундаментальных свойств биологических систем, независимо от уровня их сложности и особенностей организации, относится их способность к самовоспроизведению. Под самовоспроизводящейся будем понимать любую систему, способную к воспроизведению своих копий на основе содержащейся в ней наследственной информации.
• Одноклеточный про- или эукариотический организм представляет из себя СВ-систему минимального уровня сложности, способную к полностью автономному воспроизведению своих копий.
• Глобальными СВ-системами иерархически более высоких уровней являются биосфера Земли и ее ноосфера в понимании Вернадского
•  В СВ-системах имеются два типа регуляторных контуров: с положительной и отрицательной обратной связями
В СВ-системах имеются два типа регуляторных контуров: с положительной и отрицательной обратной связями
• Контур с отрицательной обратной связью предназначен для поддержания величины контролируемого признака X вблизи оптимального для данных средовых условий уровня Х0. Значение признака X измеряется системой рецепции и по информационному каналу передается в блок регуляции. В организмах в качестве информационных каналов используются потоки метаболитов, гормонов, медиаторов, нервных импульсов и т.д.
• Блок регуляции сравнивает текущее значение X с Х0 и продуцирует управляющий сигнал d(X - Х0). Если X значимо отклоняется от Х0, то управляющий сигнал корректирует процесс формирования признака и приближает X к оптимальной величине Х0.
• Функция контура с положительной обратной связью состоит в максимально эффективном отклонении контролируемого признака X от его исходного значения Х0 Положительные обратные связи обеспечивают быстрое самовозбуждение элементов эндокринной и нервной системы (что важно, в частности, для осуществления стрессовых ответов), а также играют ключевую роль в регуляции процессов морфогенеза, роста и развития организмов, по своему смыслу представляющих быстрый уход от первоначального состояния.
•
Роль отрицательного регуляторного контура при разных видах отбора.
• Как возникают и усложняются регуляторные системы в эволюции? Рассмотрим простейший контур с отрицательной обратной связью (ООС), регулирующий концентрацию белка. Любое отклонение концентрации белка от нормы отслеживается регуляторным звеном ООС, компенсирующим его, путем изменения скорости биосинтеза белка (эффекторное звено ООС). Причем контуру безразлична природа факторов, приводящих к отклонениям от нормы.
• Рассмотрим простейшую систему, в которой концентрация белка X в организме определяется двумя процессами: его биосинтезом и деградацией. Возмущающими воздействиями отклоняющими концентрацию белка от оптимального уровня Х0, являлись мутации, приводящие к понижению конформационной стабильности белка и как следствие - к увеличению его деградации.

• Концентрация белка X описывается следующим уравнением:
dX/dt = Кs - KdX,
где Ks и Kd - скорость синтеза белка и константа его деградации соответственно.
• Рассмотрены два варианта модели: с отрицательной обратной связью и без нее. В системе без обратной связи скорость синтеза белка постоянна, а в системе с обратной связью она зависела от концентрации белка. В рамках этой модели получены следующие основные качественные результаты.
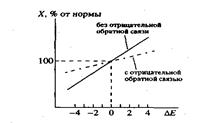
• На рисунке приведены зависимости равновесной концентрации белка от мутационного изменения стабильности, рассчитанные в варианте с отрицательной обратной связью и без нее.
• Итак, наличие в системе отрицательной обратной связи приводит к компенсации повреждающего эффекта мутаций. В данном случае это происходит за счет увеличения скорости биосинтеза белка при мутациях, увеличивающих скорость его деградации, и уменьшения скорости биосинтеза белка при мутациях, снижающих скорость его деградации.
• Суть эффекта состоит в том, что отрицательная обратная связь за счет компенсаторного изменения интенсивности регулируемых процессов минимизирует (маскирует) фенотипическое проявление мутаций. Таким образом, под влиянием отрицательных обратных связей происходит "обнейтраливание"мутационного спектра
• Мутационный спектр любого локуса (гена) характеризует распределение возникающих в нем мутаций по влиянию на приспособленность организма. Качественно можно выделить три основных класса возникающих мутаций: 1) повреждающие, 2) нейтральные, 3) адаптивные.
• Повреждающие мутации в ходе эволюции, как правило, фиксироваться не могут. Нейтральные мутации не влияют на приспособленность и могут фиксироваться в популяциях за счет генетического дрейфа. Адаптивные мутации могут фиксироваться в популяциях с весьма большой скоростью за счет положительного отбора.

• В результате обнейтраливания в мутационном спектре уменьшается доля адаптивных и повреждающих мутаций, так как наличие отрицательной обратной связи уменьшает (маскирует) их фенотипическое проявление. Соответственно увеличивается доля нейтральных мутаций. Эффект обнейтраливания тем более выражен, чем более эффективным является контроль параметра по механизму отрицательной обратной связи.
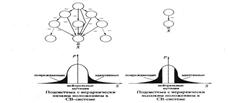
• Эффективность контроля параметра по механизму отрицательной обратной связи, в свою очередь, зависит от иерархического положения подсистемы, определяющей данный параметр, в составе СВ-системы. При низком иерархическом положении подсистемы она контролируется большим количеством отрицательных обратных связей от вышележащих подсистем, что должно приводить к более выраженному эффекту обнейтраливания. Напротив, при более высоком иерархическом положении, когда подсистема контролируется меньшим количеством отрицательных обратных связей от вышележащих подсистем, эффект обнейтраливания должен быть выражен слабее
• Таким образом, стабилизирующий и движущий/дизруптивный отборы противоположным образом влияют на регуляторные системы организмов, что приводит к так называемым эволюционным качелям. Поочередно при стабилизирующем отборе происходит возникновение и усиление ООС, а при движущем отборе - ослабление или разрушение некоторых ООС. Спектр мутаций, среди которых есть вредные, нейтральные, инадаптивные и адаптивные должен фиксироваться в геномах таксонов в период стазиса в нейтральном режиме.
• В процессе захвата новой экологической ниши (или изменения старой) происходит слом контура ООС и гиперманифестация изменчивости, после чего таксоны с вредными мутациями быстро вымирают, следом за ними в ходе отбора постепенно вымирают или вытесняются в другие экологические ниши таксоны с инадаптивными мутациями. Если это действительно так, то фиксация практически всего спектра адаптивных для новой ниши мутаций должна проходить за короткое время и именно в периоды заселения (формирования) новых экологических ниш, что подтверждают эксперименты.
Размеры геномов и плотность кодирования информации
• Различия в размерах геномов чрезвычайно велики. У мельчайших РНК-содержащих вирусов геном содержит лишь около 103 н.п., а у водорослей и амфибий до 1011 н.п.. Однако длины геномов лишь частично коррелируют с их функциональной нагрузкой и сложностью генных сетей соответствующих организмов. Под функциональной нагрузкой понимается общее количество генов, кодирующих и регуляторных РНК, белков. Размеры геномов в целом возрастают с усложнением организмов, т.е. с ростом сложности генных сетей.
• У вирусов, имеющих зависимую от хозяина и неполную генную сеть онтогенеза, минимальный размер генома равен 103 н.п. (1 ген). Среди секвенированных на данный момент прокариот наименьший клеточный геном имеет Candidatus_Carsonella_ruddii_PV (182 гена, 159662 н.п.). Самая мелкая из микоплазм - Mycoplasma_genitalium имеет 580076 н.п., 477 генов и белков. Однако, микоплазма – паразит и ей нет нужды обеспечивать кодирование всех систем, выполняющих фундаментальные генетические процессы и контролирующих базовый метаболизм, клеточные структуры и функции.
• Среди эукариот наименьшие геномы имеют низшие грибы (~ 2•107 н.п., ~ 104 генов и белков). В отличие от одноклеточных у многоклеточных эукариот нет явной зависимости между сложностью организации и размером генома (так называемый C-value парадокс).
• Гаплоидные геномы четко подразделяются на классы по максимальной длине: РНК-геномы вирусов и фагов ~ 104 н.п., ДНК-геномы вирусов и фагов ~ 5•105 н.п., геномы бактерий ~ 2•107 н.п., геномы низших грибов, имеющих длительную гаплоидную фазу ~ 2•108 н.п. Скорее всего, эти ограничения на максимальную длину генома связаны с вероятностями мутирования, которые зависят от систем репарации клеток, разных в организмах разных классов.
• Плотность кодирования генетической информации весьма различна у про- и эукариот. Вирусы, фаги, бактерии, митохондрии, хлоропласты имеют высокую плотность кодирования информации. Т.е. доля некодирующих участков в геноме невелика (у фага λ ~ 17%), гены не дублированы, иногда даже перекрываются, а размеры геномов поэтому могут служить оценкой их информационной емкости. У E. coli K12 87,8% генома занимают реальные и вероятные белок-кодирующие гены; 0,8% - гены т-РНК, р-РНК и др.; 0,7% - некодирующие повторы; 11,0% генома - функциональные сайты и другие участки, выполняющие регуляторные и другие функции. Таким образом, геном E. coli K12 очень плотно нагружен генами (~ 88,5%), а межгенные участки занимают относительно малую долю (~11%).
• В геномах эукариот плотность кодирования информации гораздо более низкая. Кодирующей является <5% ДНК генома, а >95% составляют различные мобильные элементы, интроны, псевдогены и другие некодирующие участки. Как правило, некодирущие участки содержат множество повторов, мобильные генетические элементы также существуют в основном в очень многих копиях. Однако существует достаточно много данных, говорящих о том, что некодирующие участки, тем не менее, могут играть важную роль в регуляции функционирования генома.
• Кодирующая часть генома содержит мультигенные семейства и супергены, которые дублируют гены или их фрагменты. Степень дублирования может быть велика. На данный момент секвенировано несколько сотен геномов различных организмов (в основном одноклеточных). Полученная информация позволяет говорить о так называемом G-value парадоксе: геномы эукариот содержат гораздо меньше генов, чем ожидалось и количество генов плохо коррелирует со сложностью организма.
Блочно-модульная структура макромолекул
• Процесс биологической молекулярной макроэволюции не исчерпывается заменами мономеров и небольшими делециями и вставками. Эти процессы, в основном, обеспечивают синонимическую эволюцию последовательностей, т.е. сохраняют и совершенствуют функцию.
• Однако, существуют многочисленные факты, и их становится все больше, которые указывают, что основным источником новшеств на молекулярном уровне является блочно-модульная организация и комбинаторная изменчивость макромолекул. Фактически, прогрессивная эволюция – это эволюция сложности, причем сложность следует понимать как сложность и многообразие регуляций.
• Согласно принципу "тинкеринга", для создания новых функциональных блоков используются, в основном, функционирующие фрагменты уже существующих и работающих макромолекул. Этот принцип сформулирован Ф.Жакобом (Jacob, 1977) "Естественный отбор - действует как "умелец", который не знает точно, что собирается соорудить, но использует все, что попадается ему под руку".
• Из-за синонимической изменчивости каждый тип блока представлен множеством функциональных вариантов и каждый вариант продолжает нейтрально или адаптивно эволюционировать без порождения принципиально новых вариантов. В работе генных сетей эти варианты в принципе взаимозаменяемы именно благодаря изофункциональности. Скорее всего, путь "тинкеринга" - основной путь прогрессивной эволюции, особенно для сложных систем. Этот вывод основывается на необходимости выполнения общего требования непрерывности функционирования живой системы
• Тем не менее, случайные или слабо функциональные последовательности также могут эволюционировать благодаря изменчивости и селективному усилению слабых активностей, специфичностей структурных элементов и т.п., которые редко, но встречаются даже в случайных последовательностях макромолекул. Однако путь этот очень длинен, неэффективен для эволюционных приобретений широкого профиля и потому ограничен относительно небольшими последовательностями и простыми функциями.
Блочно-модульная эволюция иммунной системы
• Надсемейство иммуноглобулинов (IgSF) объединяет в своем составе белки, структурной особенностью которых является наличие одного или более Ig-подобных доменов. IgSF относится к наиболее многочисленным по составу надсемействам, а по структурному и функциональному разнообразию составляющих его членов не имеет аналогов.
• IgSF представляет собой яркий пример прогрессивной эволюции, связанной с множественными дупликациями одного предкового гена и является исключительно интересной моделью изучения основной проблемы макроэволюции – механизмов возникновения функциональных нововведений и их встраивания в предсуществующие сети белковых взаимодействий.
• Эволюция парных рецепторов иммунной системы, относящихся к FcR и KIR семействам.
Парные рецепторы разделены на два функциональных класса, ингибирующих и активирующих молекул. Считается, что они играют важную роль в регуляции иммунного ответа посредством изменения баланса разнонаправленных сигналов.
• На основании анализа геномов нескольких видов позвоночных, установлено, что парные рецепторы FcR и KIR семейств относятся к числу наиболее диверсифицированных групп белковых молекул.
• Во-первых, количество генов, кодирующих эти рецепторы у разных видов колеблется в пределах двух порядков величины, от десятка до полутора сотен.
• Во вторых, структура парных рецепторов отличается исключительным разнообразием. Хотя в составе белков разных видов позвоночных присутствуют родственные подтипы Ig-подобных доменов, доменные архитектуры рецепторов рыб, амфибий и млекопитающих совершенно различны.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 484; Нарушение авторских прав?; Мы поможем в написании вашей работы!