
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні властивості. Метиламін, диметиламін і три метиламін – гази, інші нижчі аміни – рідини
|
|
|
|
Фізичні властивості.
Метиламін, диметиламін і три метиламін – гази, інші нижчі аміни – рідини. Нижчі газоподібні і рідкі аміни мають аміачний запах і подібно до аміаку добре розчиняються у воді. Більш складні аміни – рідини з неприємним запахом зіпсованої риби. Зі збільшенням молекулярної маси рідини збільшується температура кипіння та зменшується розчинність у воді. Вищі аміни – тверді речовини, без запаху, не розчинні у воді.
В ІЧ-спектрах первинних і вторинних амінів спостерігається поглинання в області 3300-3500 см-1, яке відповідає валентним коливанням N-H-зв'язків. Смуги поглинання, які відповідають валентним коливанням зв'язків N-С, розміщуються в області 1100-1300 см-1 і важко ідентифікуються.
Властивості амінів визначаються в першу чергу наявністю в їх молекулах аміногрупи.
1) Основні властивості амінів.
Як похідні аміаку аміни проявляють основні властивості і являються органічними основами. Водні розчини аміаку мають лужну реакцію, так як взаємодіючи з водою, аміак утворює гідроксид амонію:

Аміак – слабка основа. При нагріванні його водного розчину, приведена вище реакція протікає в зворотному напрямку й іони амонію розкладаються, утворюючи аміак і воду.
Подібно аміаку аміни утворюють з водою гідроксиди, наприклад:
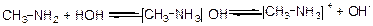
гідроксид метиламонію іон метиламонію
Гідроксиди амінів мають лужну реакцію, зафарбовують лакмус у синій колір, а фенолфталеїн – у малиновий. Більш того, під впливом алкільних радикалів основні властивості аміногрупи збільшуються, тому аміни першого ряду являються значно більш сильнішими основами, ніж аміак. Збільшення основних властивостей аміногрупи в амінах зрівняно з аміаком пояснюються електронодонорними властивостями алкільних радикалів, здібністю радикалів подавати електрони (індукційний ефект):
|
|
|

Алкіли збільшують загальну електронну густину атому азоту й здібність приєднувати протон., що віднімається при утворенні йону амонію від води. Таким чином, збільшується кількість гідроксильних іонів в розчині, тобто його основність. В ароматичних амінах основні властивості аміногрупи, безпосередньо з’єднаною з бензольним ядром, під впливом останнього послаблені, тому ароматичні аміни є більш слабкими основами ніж аміак. Так водний розчин аніліну не дає лужної реакції на лакмус.
Зниження основних властивостей аніліну зрівняно з аліфатичними амінами обумовлено спряженням неподіленої електронної пари атому азоту з π-електронною системою ядер.

При цьому знижається електронна густина на атомі азоту, а збільшується – в орто- і пара-положеннях ядра.
Особливо сильні основні властивості виявляють четвертинні амонійні основи. Так гідроксид тетраметиламонію, що дисоціює за рівнянням

по силі подібний гідроксидам Na i K.
Здобувають четвертинні амонійні основи з третинних амінів:
(CH3)3N+СH3І→[(CH3)4N]I – йодид тетараметиламонію (четвертинна амонійна сіль)
[(CH3)4N]I+AgOH→[(CH3)4]OH+AgI↓
Як основи аміни, подібно аміаку, взаємодіючи з кислотами дають сіль:
NH3+HCl→NH4Cl – хлорид амонію
2NH3+H2SO4→(NH4)2SO4 – сірчанокислий амоній
СH3-NH2+НCl→[CH3-NH3]Cl – хлорид метиламонію
або СH3-NH2∙НCl – солянокислий метиламін
2СH3-NH2+H2SO4→[CH3-NH3]2SO4 – сірчанокислий метиламоній
або 2СH3-NH2∙H2SO4 – сірчанокислий метиламін
Сіль амінів – кристалічна речовина, яка добре розчиняється у воді. Солі четвертинних амонійних основ – важливі біологічно активні речовини.
2) Алкілування амінів.
Реакція алкілування відбувається шляхом заміщення атомів водню аміногрупи алкільними радикалами та розглянута вище, як метод синтезу різних амінів (реакція Гофмана).
|
|
|
3) Ацилування амінів.
При дії галоген ангідридами або ангідридами кислот на первинні і вторинні аміни водень в аміногрупі заміщується на ацильний залишок. У випадку аліфатичних амінів здобувають алкільні похідні амідів кислот, а у випадку ароматичних амінів добувають аніліди кислот:

метиламін хлорангідрид метиламід
(первинний амін) оцтової кислоти оцтової кислоти
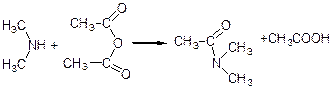
диметиламін оцтовий диметиламід
(вторинний амін) ангідрид оцтової кислоти

ацетанілід (анілід оцтової кислоти)
Третинні аміни, оскільки у них при N немає водню, в реакцію ацилування не вступають.
4) Реакції амінів з азотистою кислотою HNO2.
Ця реакція має важливе аналітичне значення, так як дозволяє розрізнити первинні, вторинні і третинні аміни.
Аліфатичні первинні аміни при взаємодії з азотистою кислотою утворюють спирти, при цьому виділяється вільний азот:
C2H5-NH2+O = N-OH→C2H5-OH+N2+H2O
Первинні ароматичні аміни інакше реагують з азотистою кислотою. У кислих розчинах первинні ароматичні аміни взаємодіють з HNO2 з утворенням діазосполук (реакцію проводять при охолодженні):

Анілін хлорид феніламонію хлорид фенілдіазонію
(солянокислий амін) (діазосполука)
Ця реакція називається реакцією діазування первинних ароматичних амінів. Діазосполуки нестійкі: при нагріванні або під дією світла вони гідролізуються, виділяючи N2 і перетворюються в феноли:
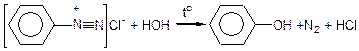
Таким чином і в ароматичних амінах первинна аміногрупа при дії азотистою кислотою може бути заміщена на гідроксильну групу.
Відрізняючи від аліфатичних амінів, первинні ароматичні аміни утворюють феноли, але реакція протікає через проміжну стадію утворення.
Вторинні аміни, як аліфатичні так і ароматичні, при взаємодії з азотистою кислотою утворюють нітроза міни:

діметилетнітрозамін
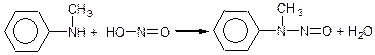
метилфенілнітрозамін
Аліфатичні третинні аміни, у яких при азоті немає водню, не реагують з азотистою кислотою.
Ароматичні третинні аміни взаємодіють з азотистою кислотою, але реакція йде по бензольному кільцю, а не по аміногрупі.
Третинна аміногрупа проявляє себе як замісник І роду, тому залишок азотистою кислоти – нітрозогрупа легко заміщує водень в бензольному ядрі в пара-положенні до аміногрупи:
|
|
|
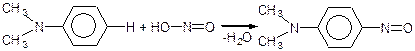
п -нітроз N, N-діметиланілін
5) Реакції за рахунок ароматичного ядра.
Ароматичні аміни легко окислюються, так як під впливом аміногрупи бензольне ядро втрачає стійкість до дії окислювачів:
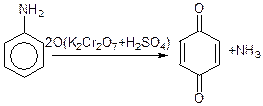
хінон
Для ароматичних амінів характерна реакція електрофільного заміщення в ароматичному ядрі. Аміногрупа, як замісник І роду, полегшує реакцію заміщення в бензольному ядрі, при цьому заміщення атомів водню відбувається в орто- і пара- положеннях до аміногрупи. Наприклад, при дії бромної води із аніліном утворюється 2,4,6-триброманілін.

Під час сульфування аніліну добувають сульфанілову кислоту:

сульфанілова кислота
(п -аміносульфабензол)
Важливе значення має амід сульфанілової кислоти, або сульфаніламід (стрептоцид):

Стрептоцид – цінний лікувальний препарат, що застосовується для лікування інфекційний захворювань. Похідні сульфаніламіду типу 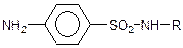 , де R – залишки різних гетероциклічних сполук, що являють собою групу дуже важливих сульфаніламідних лікувальних речовин.
, де R – залишки різних гетероциклічних сполук, що являють собою групу дуже важливих сульфаніламідних лікувальних речовин.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 14413; Нарушение авторских прав?; Мы поможем в написании вашей работы!