
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Енергія зв’язків фосфору й азоту
План
Лекція №29
Тема: Фосфорорганічні та сірковмісні органічні сполуки.
1. Загальна характеристика фосфорорганічних сполук (ФОС).
2. Властивості ФОС.
3. Застосування ФОС.
4. Загальна характеристика сірковмісних органічних сполук.
5. Методи добування сірковмісних органічних сполук.
6. Властивості сірковмісних органічних сполук.
7. Застосування сірковмісних органічних сполук.
1. Загальна характеристика ФОС.
Фосфор – елемент V групи періодичної системи Д.І. Менделєєва. Його валентні електрони знаходяться на більш високому енергетичному рівні, ніж у азоту, причому вищі займані орбіталі (ВЗО) та нижчі вакантні орбіталі (НВО) достатньо близькі за енергією для здійснення переходу одного р-електрону на 3d-орбіталь.
В цьому випадку, в утворенні зв’язку приймає участь п’ять орбіталей ((С6Н5)5Р; РСl5). Більш того, пара електронів аніону зі сторони може займати шосту орбіталь атома фосфору, внаслідок чого останній стає шестивалентним (РF6-). Максимальна валентність азоту дорівнює чотирьом:

Сполуки фосфору (V) мають форму тригональної біпіраміди:

Фосфор на відміну від азоту не утворює стабільних ненасичених сполук типу нітро-, нітрозо-, азо- та діазосполук.
Кратні зв’язки Р = О і Р = СН2 в сполуках фосфору треба розглядати як ті, що займають проміжні положення між семиполярним та π-зв’язком типу 2р-3d (участь 3d-орбіталі атома фосфору у боковому перекриванні з 2р-орбіталями атомів О та С неефективна).
Валентні електрони атому фосфору розміщуються далі від ядра, ніж в атомі азоту, та тому більш лабільні. Енергія зв’язків Р-Н та Р-С значно нижче, ніж відповідно N-Н та N-С.
| Зв'язок | Енергія кДж/моль | Зв'язок | Енергія кДж/моль |
| P-H(PH3) | N-H(NH3) | 394,8 | |
| P-C | N-C | 304,8 | |
| P-O | N-O | ||
| P-Cl(PCl3) | 326,5 | N-Cl | 192,6 |
Зв'язок Р-Н легко окислюється на повітрі. У той же час фосфор утворює більш міцні зв’язки з сильними акцепторами електронів (киснем, галогенами).
Найбільш характерними є сполуки фосфору (ІІІ) та Р (V). Родоначальником фосфору (ІІІ) є фосфорні РН3 (аналог NH3). Алкілфосфіни (R3P, R2PH, RPH2) – аналоги амінів, а солі фосфонія (R3P+H·Cl-, R4P+·Cl-) – подібні четвертинним амонієвим сполукам.
Продукти заміщення атомів водню в фосфінах на ОН-групу відносяться до кислот:


Диалкілфосфониста кислота Алкілфосфониста кислота
Характерно, що група Р-ОН нестійка та перегрупировується в сполуку фосфору (V):
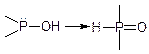
Продукти заміщення групи ОН на Наl можна розглядати як галогенангідриди відповідних кислот:
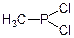
Дихлорангідрид метилфосфонистої кислоти (метилдихлорфосфін)
|
|
Дата добавления: 2014-01-07; Просмотров: 723; Нарушение авторских прав?; Мы поможем в написании вашей работы!