
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Деякі властивості частинок, з яких складається атом
|
|
|
|
| Частинка | Заряд | Спін, 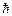
| Маса ( ), МеВ ), МеВ
| Час життя |
| p | + e | 1/2 | 938,272 | > 1032 років |
| n | 1/2 | 939,565 | 887 2 с 2 с
| |
| e | - e | 1/2 | 0,511 | > 4,2·1024 років |
 Ядра позначаються символом хімічного елемента й кількістю А нуклонів у ядрі. При описі атомних ядер використовують наступні позначення: кількість протонів Z, кількість нейтронів N, масове число А (кількість нуклонів): А = Z + N. Ядра з однаковим Z називають ізотопами, а з однаковим А - ізобарами. Конкретне ядро (нуклід) найчастіше позначають
Ядра позначаються символом хімічного елемента й кількістю А нуклонів у ядрі. При описі атомних ядер використовують наступні позначення: кількість протонів Z, кількість нейтронів N, масове число А (кількість нуклонів): А = Z + N. Ядра з однаковим Z називають ізотопами, а з однаковим А - ізобарами. Конкретне ядро (нуклід) найчастіше позначають  , де X - хімічний символ елементу, або просто (А, Z). Наприклад, ізотоп алюмінію, що складається з 27 нуклонів, позначають
, де X - хімічний символ елементу, або просто (А, Z). Наприклад, ізотоп алюмінію, що складається з 27 нуклонів, позначають  , ядро гелію (
, ядро гелію (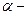 частинка)
частинка) 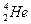 .
.
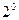 . Метод, що дозволив отримати висновок про існування ядра, типовий для субатомної фізики (рис. 9.2): у тонку мішень направляють колімований пучок частинок і вимірюють кутовий розподіл (вірогідність вильоту під різними кутами) вторинних частинок.
. Метод, що дозволив отримати висновок про існування ядра, типовий для субатомної фізики (рис. 9.2): у тонку мішень направляють колімований пучок частинок і вимірюють кутовий розподіл (вірогідність вильоту під різними кутами) вторинних частинок.
Аналіз результатів дає відомості про природу взаємодії і структуру об'єкту (мішені). У досліді Резерфорда було виявлено, що приблизно в одному випадку з 104 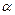 - частинка міняє імпульс на протилежний. Це не можна пояснити в моделі Томсона, в якій атом - дуже рихла система і сили, що діють на
- частинка міняє імпульс на протилежний. Це не можна пояснити в моделі Томсона, в якій атом - дуже рихла система і сили, що діють на 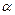 - частинку дуже малі, щоб різко змінити її траєкторію. Повернути
- частинку дуже малі, щоб різко змінити її траєкторію. Повернути 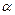 - частинку назад може лише об'єкт з масою
- частинку назад може лише об'єкт з масою 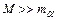 .
.
Кінетична енергія 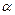 - частинки Та в описуваних дослідах була 5 МеВ. Звідси легко зробити вибір між моделлю атома Томсона і Резерфорда. Ядерна модель атома Резерфорда зовні нагадує Сонячну систему. Навколо ядра (сонця) в області з лінійними розмірами
- частинки Та в описуваних дослідах була 5 МеВ. Звідси легко зробити вибір між моделлю атома Томсона і Резерфорда. Ядерна модель атома Резерфорда зовні нагадує Сонячну систему. Навколо ядра (сонця) в області з лінійними розмірами 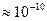 м рухаються по орбітах електрони (планети). Тому цю модель атома назвали планетарною.
м рухаються по орбітах електрони (планети). Тому цю модель атома назвали планетарною.
 Знайдемо для зворотного (на 180°) розсіяння, тобто для лобового зіткнення (рис. 9.3), відстань найбільшого зближення
Знайдемо для зворотного (на 180°) розсіяння, тобто для лобового зіткнення (рис. 9.3), відстань найбільшого зближення  , що відповідає рівності кінетичної енергії Та енергії кулонівського відштовхування
, що відповідає рівності кінетичної енергії Та енергії кулонівського відштовхування  :
:
|
|
|
 ,
,
 (9.6)
(9.6)
Ми використовуємо Гауссову систему одиниць і позасистемні одиниці:
1 фермі = 1 Фм = 10-13 см, 1 еВ = 1,6∙10-12 ерг.
 . У найпростішому атомі – атомі водню – навколо ядра обертається один електрон. Орбіти електронів в атомі стаціонарні, атом – дуже стійка система, про що свідчать оптичні лінійчаті спектри атома водню та інших атомів, які характеризуються певним для всіх атомів даного елемента розташуванням спектральних ліній. Згідно з класичним розумінням ядерної моделі атома Резерфорда не можна пояснити стійкість атома та існування лінійчатого спектра його випромінювання.
. У найпростішому атомі – атомі водню – навколо ядра обертається один електрон. Орбіти електронів в атомі стаціонарні, атом – дуже стійка система, про що свідчать оптичні лінійчаті спектри атома водню та інших атомів, які характеризуються певним для всіх атомів даного елемента розташуванням спектральних ліній. Згідно з класичним розумінням ядерної моделі атома Резерфорда не можна пояснити стійкість атома та існування лінійчатого спектра його випромінювання.
З погляду класичної електродинаміки електрон, обертаючись навколо ядра з прискоренням, має випромінювати електромагнітні хвилі. Це випромінювання відбувається постійно, електрон поступово втрачає свою енергію і має рухатися по спіралі до ядра. Але тоді випромінювання атома має бути із суцільним спектром., а електрон неминуче має впасти на ядро, що призведе до руйнування атома. Рішення цієї проблеми знайшов у 1913 роцф датський фізик Нільс Бор. Він створив теорію будови і випромінювання атома водню і вонеподібних атомів, яка ґрунтується на моделі атома Резерфорда. Однак, йому довелося зробити припущення, зовсім чужі класичним уявленням. Ці припущення Бор сформулював як постулати.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 434; Нарушение авторских прав?; Мы поможем в написании вашей работы!