
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Солі амонію та їх властивості, важливі в аналізі
Особливості якісних реакцій катіонів І групи.
Фактично усі характерні реакції катіонів І групи є реакціями обміну, тому вони досить прості. В цих визначеннях широко застосовуються комплексні, подвійні та кислі солі. При проведенні реакції слід суворо притримуватись певних умов. В іншому випадку результат може бути випадковим. Покажемо це на прикладі визначення катіонів Na+ за допомогою гексагідроксостибіату (V) калію:
K[Sb(OH)6] + NaCl = Na[Sb(OH)6]↓ + KCl
Ця реакція повинна проводитись у нейтральному середовищі, бо у кислому реактив розкладається з випадінням осаду:
K[Sb(OH)6]↓ + HCl = HSbO3↓ + KCl + 3H2O,
а в лужному характерній осад, навпаки, розчиняється:
Na[Sb(OH)6]↓ + 2NaOH = Na3SbO4 + 4H2O
Оскільки утворені осади схильні до утворення пересичених розчинів, то визначення слід проводити з концентрованих розчинів, потирати скляною паличкою стінки пробірки, охолоджувати розчин під холодною проточною водою.
Іон амонію, як відомо, утворюється за рахунок донорно – акцепторного зв’язку:
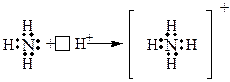
При кристалізації з розчину утворюються солі амонію: NH4Cl, NH4NO3, (NH4)2SO4, (NH4)3PO4 тощо.
Амонійні солі заважають відкриттю іонів калію, магнію, розкладають K[Sb(OH)6]. У цих випадках катіони NH4+ слід видалити. Існує декілька методів їх видалення.
Термічний розклад. Деякі солі амонію розкладаються вже при відносно невисоких температурах. Наприклад:
(NH4)2CO3 = 2NH3↑ + CO2↑ + H2O↑
NH4Cl = NH3↑ + HCl↑
Амонійні солі нелетких кислот (сірчаної, ортофосфатної) розкладаються лише за температури червоного каління (500-600◦С):
(NH4)3PO4 = NH3↑ + H3PO4
Дещо інакше розкладаються нітрат і нітрит амонію:
NH4NO3 = N2O + 2H2O
NH4NO2 = N2↑ + 2H2O↑
|
|
Дата добавления: 2014-01-07; Просмотров: 723; Нарушение авторских прав?; Мы поможем в написании вашей работы!