
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні рівноваги у гетерогенних системах. Добуток розчинності та його значення в аналізі
|
|
|
|
З усіх гетерогенних систем найбільше значення в аналітичній хімії мають системи тверда фаза – рідина. З такого роду системами доводиться зустрічатися у процесі осадження, відділення, розчинення і промивання осадів. При здійсненні екстракції мають місце процеси обміну між двома рідинами, що не змішуються
Під час контакту розчину з осадом встановлюється рівновага:
 осад розчин,
осад розчин,
причому у випадку електролітів розчинення супроводжується дисоціацією. Так, наприклад, між осадом AgCl та його насиченим розчином встановлюється рівновага що схематично показано на малюнку 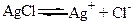
тв. розчин

Ag+ Cl- ——розчин
↑ ↓
 ——осад AgNo3
——осад AgNo3
константа рівноваги цього процесу

Але [AgClтв] = const = K. Отже
Kp∙K = [Ag+][Cl-]
ДРAgCl = [Ag+][Cl-]
У загальному випадку електроліту AxBy
AxBy 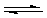 xAy+ + yBx-, а
xAy+ + yBx-, а
ДРAxBy = [Ay+]x[Bx-]y, наприклад
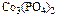 ДР = [Ca2+]3[PO43-]2
ДР = [Ca2+]3[PO43-]2
Отже, добуток розчинності є добуток молярних концентрацій іонів електроліту в його насиченому розчині.
Дуже важливим для практики аналізу є правило постійності ДР: за умови встановлення рівноваги у насиченому розчині малорозчинного електроліту за певного тиску і температури незалежно від зміни концентрації окремих іонів величина ДР залишається незмінною.
Добуток розчинності зазвичай обчислюють за даними розчинності електроліту.
Приклад. Відомо, що розчинність Mg(OH)2
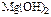
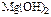 P = 1,7∙10-4моль/л. Обчислити ДР
P = 1,7∙10-4моль/л. Обчислити ДР
Рішення
Mg(OH)2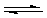 Mg2+ + 2OH-
Mg2+ + 2OH-
 ДР = [Mg2+][OH-]2
ДР = [Mg2+][OH-]2
 [Mg2+] = P = 1,7∙10-4моль/л.
[Mg2+] = P = 1,7∙10-4моль/л.
[OH-] = 2[Mg2+] = 2∙1,7∙10-4моль/л.
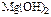 ДР = 1,7∙10-4∙(3,4∙10-4) 2 = 1,96∙10-11
ДР = 1,7∙10-4∙(3,4∙10-4) 2 = 1,96∙10-11
На практиці часто, навпаки, необхідно, користуючись табличними значеннями ДР, визначити розчинність тієї або іншої сполуки.
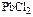
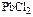 Приклад. ДР = 8∙10-9.Визначити Р
Приклад. ДР = 8∙10-9.Визначити Р
|
|
|
Рішення.
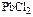 Позначимо розчинність солі через Х. Отже Р = Х. З рівняння дисоціації солі
Позначимо розчинність солі через Х. Отже Р = Х. З рівняння дисоціації солі
PbI2 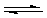 Pb2+ + 2I-
Pb2+ + 2I-
очевидно, що [Pb2+] = X, a [I-] = 2X
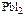 ДР = [Pb2+][I-]2, або
ДР = [Pb2+][I-]2, або
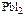 Х∙(2Х)2 = ДР = 8∙10-9
Х∙(2Х)2 = ДР = 8∙10-9
Х = 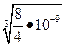 = 1,3∙10-3моль/л.
= 1,3∙10-3моль/л.
Від величини розчинності, вираженої в моль/л, легко перейти до розчинності в г/л:2-
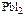
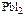 Рг/л = Р ∙М = 1,3∙10-3
Рг/л = Р ∙М = 1,3∙10-3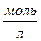 ∙461
∙461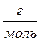 = 6 ∙ 10-1 = 0,6
= 6 ∙ 10-1 = 0,6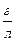
Це, в свою чергу, дозволяє розрахувати наші речовини, яка міститься у певному обємі розчину для розчинення певної кількості твердої речовини. Розрахуємо, скільки води треба взяти, щоб розчинити, наприклад, 10г PbI2. Користуємось пропорцією
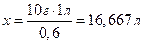 0,6г PbI2 – 1 л H2O
0,6г PbI2 – 1 л H2O
10г PbI2 – x л H2O
За умови постійності добутку розчинності випливає дуже важливий для якісного, а особливо кількісного гравіметричного методів аналізу: − додаванні у розчин одноіменного з осадом іона призводить до зменшення концентрації у розчині другого іона. Пояснимо це на прикладі осадженняя барію а вигляді сульфату:
Ba2+ + SO4- = BaSO4↓
 ДР = [Ba2+][SO42-]=1,1∙10-10
ДР = [Ba2+][SO42-]=1,1∙10-10
У даному розчині при еквівалентному співвідношенні [Ba2+]=[SO42-] концентрація іонів барію дорівнює 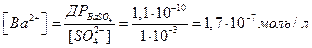
Однак, три збільшенні концентрації осаджавача слід остерігатись можливості комплексоутворення і досягнення протележного ефекту – збільшення розчинності осаду. Про це йшлося на прикладі AgCl і PbCl2, а також HqI2
За допомогою ДР можна визначити концентраційні умови випадіння і розчинення осадів. Існує правило: якщо добуток концентрації іонів у розчині більша за ДР, осад утворюється, якщо менше – розчиняється.
 Приклад. Чи буде утворюватись осад при зливанні рівних об`ємів H2SO4 і BaCl2 концентрацією 10-4моль/л. ДР =1,1∙10-10
Приклад. Чи буде утворюватись осад при зливанні рівних об`ємів H2SO4 і BaCl2 концентрацією 10-4моль/л. ДР =1,1∙10-10
Рішення
 Іонний добуток
Іонний добуток  . Оскільки цей добуток дещо більший за ДР можна зробити висновок, що осад випадати буде
. Оскільки цей добуток дещо більший за ДР можна зробити висновок, що осад випадати буде
На останок слід відмітити, що на величину добутку розчинності має вплив присутність сторонніх електронів, так званий „сольовий ефект”. Звичайно при цьому розчинність підвищуеться
|
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1045; Нарушение авторских прав?; Мы поможем в написании вашей работы!