
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рівновага в процесах масообміну
Процеси переходу маси з однієї фази в іншу в заізольованій замкненій системі, що складається з двох або більше кількості фаз, виникає самочинно і триває доти, доки між фазами за даних умов (температури й тиску) не встановиться рухома рівновага, яка характеризується тим, що за одиницю часу з першої фази в другу переходить стільки молекул (атомів, іонів) розподілюваного компонента, скільки другої фази в першу (тобто в результаті переходу речовини з однієї фази в іншу не відбувається). Досягнувши стану рівноваги, система може перебувати в ньому без кількісних і якісних змін як завгодно довго, поки зовнішня дія не виведе з цього стану. Отже стан заізольованої системи при рівновазі визначається тільки внутрішніми умовами. Тому градієнти інтенсивних параметрів і відповідні їм потоки мають дорівнювати нулю:
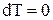 ;
;  ;
;  , (1)
, (1)
де Т – температура; р – тиск;  - хімічний потенціал і -го компонента.
- хімічний потенціал і -го компонента.
Вирази (1) називаються умовами термічної, механічної й хімічної (математичної) рівноваги відповідно.
При цьому, згідно з другим законом термодинаміки, в умовах рівноваги градієнт ентропії S системи також дорівнює нулю:
 . (2)
. (2)
Усі самочинні процеси відбуваються в напрямку досягнення рівноваги.
Чим більше стан системи відхиляється від рівноваги, тим вища швидкість процесу внаслідок збільшення рушійної сили, що обумовлює цей процес. Тому для перенесення маси не слід допускати встановлення рівноваги, для чого до системи підводять речовину. На практиці у відкритих системах цю умову зазвичай реалізують шляхом створення відносного руху фаз в масообмінних апаратах (з протитечійним, прямотечійним та іншими схемами руху потоків).
|
Дата добавления: 2014-01-07; Просмотров: 459; Нарушение авторских прав?; Мы поможем в написании вашей работы!