
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчинність
|
|
|
|
Розчинність різних речовин в одному і тому ж розчиннику або якої небудь речовини в різних розчинниках може коливатися в досить широких межах. Кількісно розчинність визначають вмістом речовини (концентрацією) в насиченому розчині. Найчастіше розчинність (k) визначають числом одиниць маси безводної речовини, що насичує за певних умов 100 одиниць маси розчинника
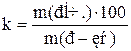 .
.
Насичені розчини характеризуються динамічною рівновагою (при постійній температурі):
Нерозчинена речовина Û Речовина в розчині.
У таких розчинах міститься максимальна при даній температурі кількість речовини.
Насиченим розчином називається такий розчин, який знаходиться в рівновазі з твердою фазою розчиненої речовини і містить максимально можливу за даних умов кількість цієї речовини.
Якщо розчин містить менше розчиненої речовини, чим необхідно для насичення, то такий розчин називається ненасиченим. У ненасичених розчинах межа насичення не досягнута, але, змінюючи, наприклад, температуру розчину, можна її досягти.
Деякі речовини можуть утворювати так звані пересичені розчини, які при певній температурі містять більше розчиненої речовини, чим це обумовлено межею розчинення. Проте на відміну від насичених розчинів, які є термодинамічно стабільними системами, пересичені розчини – метастабільні (нестійкі) системи. Вони утворюються при повільному і обережному охолодженні насичених розчинів деяких речовин. Тому при внесення в такий розчин затравки у вигляді кристала тієї ж самої речовини, яка утворює пересичений розчин, або іншої речовини з подібною кристалічною формою, в осад випадає (кристалізується) надлишок цієї речовини, а розчин стає насиченим (стабільним), в ньому встановлюється рівновага:
|
|
|
Осад Û розчинена речовина (розчин)
Пересичені розчини утворюють такі солі, як сульфат і тіосульфат натрію Na2SO4 і Na2S2O3.
Розчинність газів в рідинах залежить від тиску і температури. Крім того, необхідно враховувати хімічну природу газу і можливість утворення хімічних сполук при взаємодії газу з розчинником. За однакових умов (температурі і тиску) розчинності у воді азоту і аміаку неоднакові. Насправді, аміак енергійно взаємодіє з водою, утворюючи амоній гідроксид:
NH3 + H2O = NH4OH,
тоді як молекулярний азот не утворює з водою ніяких сполук. От чому при кімнатній температурі в одному об'ємі води розчиняється всього 0,02 об'єми азоту і приблизно 700 об'ємів аміаку.
Залежність розчинності газу від тиску виражається законом Генрі-Дальтона: розчинність газу при постійній температурі в рідині прямо пропорційна його парціальному тиску.
m = kp,
де m – маса газу, який розчиняється в 1 л розчинника; р – тиск газу (або парціальний тиск у разі суміші газів); k – коефіцієнт, який характеризує природу компонентів розчину.
Розчинність газів при постійному тиску зменшується із зростанням температури. Кип'ятінням розчину можна практично повністю позбавитися розчинених в рідині газів.
Розчинність різних твердих речовин в одному і тому ж розчиннику може змінюватися в широких межах. При підвищенні температури розчинність більшості твердих речовин збільшується, проте для деяких сполук вона може зменшуватися. Зменшення розчинності з підвищенням температури характерне для речовин, розчинення яких супроводжується виділенням теплоти. Це, наприклад, Ca(OH)2, гіпс CaSO4×2H2O. В деяких випадках зменшення розчинності обумовлене зміною характеру твердої фази, яка насичує розчин. Наприклад, Na2SO4×10H2O при температурі 32,4°С зневоднюється і розчинність безводого Na2SO4 зменшується при підвищенні температури.
|
|
|
Існують таблиці розчинності твердих речовин. На підставі таблиць розчинності можна зробити висновки щодо доцільності очищення від домішок речовин перекристалізацією. Якщо розчинність солі різко змінюється з підвищенням температури (наприклад, розчинність KNO3 при 0°С дорівнює 13,3 г солі на 100 г води, а при 100°С – відповідно 246 г), то вихід солі після її перекристалізації досягає 80-90% від узятої для очистки цим методом кількості речовини.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 500; Нарушение авторских прав?; Мы поможем в написании вашей работы!