
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Де М – молярна маса відновника
|
|
|
|
Де М – молярна маса окисника
n – число прийнятих електронів молекули окисника в даній реакції.
Під еквівалентною масою відновника розуміють кількість речовини в г/моль, яке еквівалентно одному відданому електрону однією молекулою відновника в даній реакції.
Е = 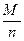
n – число прийнятих електронів, відданих однією молекулою відновника в даній реакції.
Окисник взаємодіє з розчином відновника в об’ємах, зворотно пропорційних їх еквівалентним концентраціям. Таке титрування називають прямим.
При зворотному титруванні точний об’єм невідомого окисника обробляється точним надлишковим об’ємом відомого відновника, лишок якого відтитровується еквівалентним об’ємом відомого окисника.
При титруванні по заміщенню точний об’єм відомого окисника з розчину йодиду калію у кислому середовищі виділяє еквівалентну кількість йоду, яке відтитровується еквівалентним об’ємом розчину тіосульфату натрію.
У процесі титрування по методу окислення-відновлення змінюються окисно-відновні потенціали взаємодіючих один з одним речовин. Якщо реакція проходить з участью іонів водню, то її можна записати в загальному виді:
а О к + nН+ +n е D в Вос. + 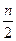 Н2О.
Н2О.
Залежність окисно-відновного потенціалу від концентрації окисленої та відновленої форми, і концетрації іонів водню виражається за рівнянням Нериста:
Еок/від = Е0ок/від + 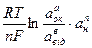
де аок, авід – концентрації іонів окисленої та відновненої форми, моль/л;
ан – концентрація іонів водню, моль/л;
Еок/від – окисно-відновний потенціал, В;
Е0ок/від – стандартний окисно-відновний потенціал, В;
R – молярна газова постійна, Дж/моль×К;
n – кількість електронів, які приймають участь у окисно-відновній реакції, моль;
|
|
|
T – абсолютна температура, К;
F – постійна Фарадея, 96500 Кл×моль-1;
a,b,n – стехіометричний коефіцієнт.
Якщо підставити числове значення констант, відповідних 200С, і перейти до натуральних логорифмівдо десятичних, то рівняння Нериста прийме вид:
Еок/від = Е0ок/від + 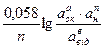
Багато окисно-відновних реакцій зворотні. Напрямок і повноту протікання окисно-відновної реакції можна визначити, виходячи із константи рівноваги.
2Fe3+ + Sn2+ D 2Fe2+ + Sn4+
в момент рівноваги наступає рівності потенціалів реагуючих речовин 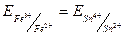
Стан динамічної рівноваги характеризується константою:
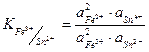
де 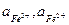 - концентрація іонів заліза окисленої та відновненої форми, моль/л;
- концентрація іонів заліза окисленої та відновненої форми, моль/л;
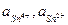 - концентрація іонів олова окисленої та відновненої форми, моль/л.
- концентрація іонів олова окисленої та відновненої форми, моль/л.
Значення константи дозволяє оцінити повноту протікання реакції. Для визначення константи рівноваги необхідно використовувати рівняння, які виражають її залежність від нормальних окисно-відновних потенціалів реагуючих пар:
lgK = 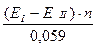
де 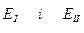 - стандартні окисно-відновні потенціали окисника та відновника, В;
- стандартні окисно-відновні потенціали окисника та відновника, В;
n – кількість електронів, які приймають участь у віденовленні 1 моль окисника, моль.
Велике значення константи рівноваги значать, що реакція є практично незворотньою і тому використовується у кількісному аналізі.
Реакція окислення-відновлення, відрізняється від реакції нейтралізації, осадження і комплексоноутворення, протікає з вимірювальною швидкістью. Тому при використанні окисно-відновних реакцій у титриметричному методі аналізу використовують засоби для підвищення швидкості реакції: збільшують концентрацію реагуючих речовин, підвищують температуру, вводят каталізатор.
В процесі оксидиметричного титрування, у зв’язку зі зміненням концентрації реагуючих іонів, безпереривно змінюється потенціал системи. Після додавання кожної порції розчину в системі буде встановлюватись рівновага потенціалів реагуючих речовин. Коли стан системи приближується до еквівалентного співвідношення реагуючих компонентів, потенціал системи змінюється довольно різко, таке явище називають “стрибком” потенціалу, а при досягненні системою еквівалентності, потенціал системи має данне значення. Графічне зображення змінення потенціалу системи у координатах: додаваємого окисника або відновника – потенціал системи, називають кривою редокс-титрування.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 477; Нарушение авторских прав?; Мы поможем в написании вашей работы!