
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
План лекції. Спеціальність: 6.030510 Товарознавство та торговельне підприємництво Курс I
|
|
|
|
Лекція26
Спеціальність: 6.030510 Товарознавство та торговельне підприємництво Курс I
ЦЕНТРАЛЬНА СПІЛКА СПОЖИВЧИХ ТОВАРИСТВ УКРАЇНИ
(УКООПСПІЛКА)
Хмельницький кооперативний торговельно-економічний інститут
Розглянуто та затверджено на засіданні
кафедритоварознавства та торговельногопідприємництва
протокол № __ від _______ 20__ р.
Завідувачкафедри
_____________ к. т. н., доцент Кулик В. М.
Дисципліна: "Хімія"
Лекція-презентація
Тема. Поверхневіявища та адсорбція.Хроматографія
Навчальна мета: Сформувати поняття про адсорбцію як хімічний процес та можливості його використання в професійній діяльності. Розглянути основні аспекти, які впливають на адсорбцію.Розкрити сутність основних аспектів хроматографічних методів аналізу, види даного методу та можливості застосування у товарознавчій практиці.
Виховна мета: Формуватиякостіособистостістудентів та пізнавальнийінтерес.
Розвивальна мета: Спонукати до пізнавальної, наукової, творчоїдіяльності; розвиватисамостійність та творчемислення.
Методична мета: Використанняпрезентації на занятті як засобуактивізаціїпроцесунавчання.
1. Поняття про адсорбцію.
2. Властивості деяких адсорбентів.
3. Адсорбція на межі тверде тіло — розчин.
4. 
 Адсорбція розчинених електролітів твердою фазою.
Адсорбція розчинених електролітів твердою фазою.
5. Поняття про хроматографічний адсорбційний аналіз. Іонообмінна хроматографія.
Технічнізасобинавчання:
· Інтерактивнадошка
· Мультимедійний проектор
· Персональнийкомп’ютер
Наочність:
· Тематичнапрезентація в PowerPoint.
· Опорний конспект до лекції №26
· Уривокнавчальноговідефільму
Міждисциплінарнізв’язки:
Забезпечувані: Товарознавствопродовольчихтоварів, Санітарний контроль,
|
|
|
Забезпечуючі: харчовахімія, хімія, фізика, екологія, матеріалознавство.
Основна література.
153. Скоробагатий Я. П., Петровська Н.О. Хімія і методи дослідження сировини та матеріалів. Навчальний посібник. – Львів: Новий Світ – 2009 – 432 с.
154. Хімія і методи дослідження сировини та матеріалів: Навч. Посіб. Рекомендовано МОН/ Іващенко О. Д., Нікозять О. Б., - К., 2011. – 606с.
155. Рейтер Л.Т., Степаненко О.М., Басов В.П., Теоретичні розділи загальної хімії. Київ.: „Каравела”, 2003. – 342 с.
156. Сегеда А.С. Аналітична хімія. Якісний і кількісний аналіз. К.: ЦУЛ, 2003. –311с.
Додаткова література.
157. Глінка М.Г., Загальна хімія. – К.: Вища школа, 1982. – 607с.
158. Басов В.П., Родіонов В. М. „Хімія”. Київ.: „Каравела”, 2004. – 318 с.
159. Омелян В.І., Зайцева І.В. Хімія і методи дослідження сировини та матеріалів: Методичні рекомендації. Частина 1. Методичні рекомендації до самостійної роботи студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”,7.0503.02 “Товарознавство та експертиза в митній справі”. –Полтава: РВВ ПУСКУ, 2004. – 23 с.
1. Поняття про адсорбцію.
Адсорбцією називається концентрування газоподібної або розчиненої речовини на поверхні розділу фаз. Газ або розчинену речовину прийнято називати в цьому випадку адсорбтивом, а рідина або тверде тіло, що адсорбувало їх, — адсорбентом.
Адсорбцію газів вугіллям спостерігав ще в XVIII в. Шеєле. На явище адсорбції речовин з розчину вперше звернув увагу в 1785 р. російський академік Т. Е. Ловіц. Французький учений Соссюр в 1814 р. знайшов, що всі пористі тіла, тобто тіла з великою поверхнею, здатні адсорбувати гази і що при цьому зазвичай виділяється тепло. Соссюр зробив також дуже важливе спостереження, що адсорбція йде тим краще, чим легше зріджується газ. В кінці XIX в. Гіббс розробив загальну термодинамічну теорію адсорбції. У XX в. явище адсорбції детально досліджували Ленгмюр, Поляні, Брунауер, Де Бур.
|
|
|
Розрізняють фізичну, або ван-дер-ваальсовуадсорбцію і хімічну адсорбцію, або хемосорбцію. У першому випадку адсорбційні сили мають ту ж природу, що і міжмолекулярні, або ван-дер-ваальсові, сили. Фізична адсорбція завжди зворотня. При хімічній адсорбції адсорбційні сили мають хімічну природу. Хемосорбція зазвичай незворотня. 



 При хімічній адсорбції молекули адсорбтива, пов'язані з адсорбентом міцними хімічними силами, й не можуть переміщуватися по поверхні останнього. На відміну від цього при фізичній адсорбції можуть мати місце як нелокалізована адсорбція, коли молекули адсорбтива здатні пересуватися по поверхні адсорбенту, так і локалізована адсорбція, коли молекули адсорбтива не можуть переміщатися по поверхні. Локалізована фізична адсорбція пояснюється тим, що поверхня адсорбенту складається з різних атомів, іонів або молекул, які по різному взаємодіють з молекулами адсорбенту. Щоб молекули адсорбтива могли пересуватися по поверхні адсорбенту, очевидно, вони повинні долати певні потенційні бар'єри. Проте дуже часто подолання таких бар'єрів, якщо вони достатньо великі, неможливе. Зрозуміло, що з підвищенням температури локалізована фізична адсорбція може переходити в нелокалізовану унаслідок зростання кінетичної енергії молекул і їх здатності долати потенційний бар'єр.
При хімічній адсорбції молекули адсорбтива, пов'язані з адсорбентом міцними хімічними силами, й не можуть переміщуватися по поверхні останнього. На відміну від цього при фізичній адсорбції можуть мати місце як нелокалізована адсорбція, коли молекули адсорбтива здатні пересуватися по поверхні адсорбенту, так і локалізована адсорбція, коли молекули адсорбтива не можуть переміщатися по поверхні. Локалізована фізична адсорбція пояснюється тим, що поверхня адсорбенту складається з різних атомів, іонів або молекул, які по різному взаємодіють з молекулами адсорбенту. Щоб молекули адсорбтива могли пересуватися по поверхні адсорбенту, очевидно, вони повинні долати певні потенційні бар'єри. Проте дуже часто подолання таких бар'єрів, якщо вони достатньо великі, неможливе. Зрозуміло, що з підвищенням температури локалізована фізична адсорбція може переходити в нелокалізовану унаслідок зростання кінетичної енергії молекул і їх здатності долати потенційний бар'єр.
Фізична адсорбція протікає мимоволі. Адсорбтив прагне зайняти всю поверхню адсорбенту, але цьому перешкоджає процес, зворотній адсорбції — десорбція, викликана, як і дифузія, прагненням до рівномірного розподілу речовини унаслідок теплового руху. Для кожної концентрації адсорбтива в навколишньому середовищу існує стан адсорбційної рівноваги, аналогічний рівновазі між конденсацією і випаровуванням. Зрозуміло, що чим вище концентрація адсорбтива, тим більше адсорбція. Також ясно, що чим вище температура, тим менше фізична адсорбція. Для кожної температури також існує свій стан рівноваги. Вплив температури на фізичну адсорбцію цілком узгоджується зпринципом ЛеШателье — Брауна, оскільки десорбція як процес, зворотний адсорбції, супроводжується поглинанням тепла.
Для визначення кількості адсорбованої речовини необхідно експериментально знайти тиск газу або концентрацію адсорбтива в судині, в якій відбувається адсорбція, до і після адсорбції. Дуже часто кількість адсорбованої речовини визначають по збільшенню ваги адсорбенту. Слід відмітити, що визначення кількості адсорбованої речовини викликає часто великі труднощі, що завжди мають місце, коли мала величина є різницею двох великих. Аби зменшити помилку вимірювань, визначення зазвичай проводять, застосовуючи як адсорбент пористі тіла з великою питомою поверхнею, що зв'язують велику кількість адсорбтива. Проте це у свою чергу має той недолік, що на адсорбції може позначатися діаметр пір адсорбенту. Порівняно великі молекули адсорбтива не зможуть проникати у вузькі капіляри адсорбенту і досягнута межа адсорбції буде фіктивною величиною, що не характеризує адсорбційну взаємодію адсорбтива з адсорбентом. При малих радіусах пір може відбуватися зріджування адсорбтива (капілярна конденсація) і отримують завищені значення кількості адсорбованої речовини.
|
|
|
Кількісно адсорбція може бути виражена з допомогою декількох величин:
1. Величиною а, що є кількістю адсорбтива, що знаходиться в одиниці маси адсорбенту. Цю величину зазвичай вимірюють у моль/г.
2. Величиною α, що показує кількість адсорбованої речовини, що доводиться на одиницю поверхні адсорбенту. Ця величина є ніщо інше, як поверхневу концентрацію адсорбтива. Одиницями вимірювання її є моль/м2і ммоль/см2.
3. Введеною Гіббсомвеличиной Г, що є надлишок числа молів адсорбтива в об'ємі поверхневого шару площею 1 см2 по порівнянню з числом його молів в тому ж об'ємі,якби на міжфазній межі не відбувалося зміни концентрації адсорбтива. При малих концентраціях адсорбтивагіббсівская адсорбція Г близька до поверхневої концентрації α, привеликих концентраціях адсорбтива величина Г відрізняється від α.У випадках, коли по тих або інших причинах концентрація адсорбтива в поверхневому шарі менше його концентрації в об'ємі,величина Г негативна, а саме явище називається негативною адсорбцією.
|
|
|
Адсорбцію можна характеризувати:
1) залежністю кількості адсорбованої речовини а від температури при постійних рівноважних тисках р або концентраціях с;графіки а = f(T) при р = const називаються ізобарами, а при с = const — ізопікнами адсорбції;
2) залежністю рівноважного тиску (або концентрації) від температури при постійній кількості адсорбованої речовини; графіки р = f(T) і с = f(T) при а = const називаються ізостерам.
3) залежністю кількості адсорбованої речовини а від
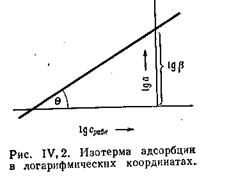
рівноважного тиску (або концентрації) при постійній температурі; графіки а = f(p) або а = f (с) при Т = const називаються ізотермами адсорбції. Ізотерми мають особливо велике значення при вивченні адсорбції.

|
|

|

|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 753; Нарушение авторских прав?; Мы поможем в написании вашей работы!