
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. 1.Диеновые углеводороды обладают более высокой температурой кипения, чем олефины:
|
|
|
|
Физические свойства
1. Диеновые углеводороды обладают более высокой температурой кипения, чем олефины:
1,3-бутадиен - +4,5оС; 1-бутен – 6,3оС.
2. Плотность их также выше, чем у олефинов, т.к. растет % содержания С: у пентена – 0,64
у пентадиена – 0,70.
3. Также выше показатель преломления (1,4 – 1,47 вместо 1,36 – 1,38 у этиленовых) – экзальтация МR.
Сопряженные диены дают все химические реакции, характерные для двойных связей. Отличительные особенности:
1. Более высокая термодинамическая стойкость.
2. Более высокая реакционная способность из-за очень большой поляризуемости.
3. Способность к присоединению по концам цепочки сопряженных связей.
1. Реакции присоединения
1. Присоединение водорода, галогенов, галогеноводородов может идти в положении 1,2 и в положении 1,4. Например, присоединение НCl, происходящее по электрофильному (ионному) механизму:
1 2 3 4 + +



 СH2=CH-CH=CH2 + H+
СH2=CH-CH=CH2 + H+  CH2=CH-CH-CH3
CH2=CH-CH-CH3 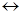 CH2-CH=CH-CH3
CH2-CH=CH-CH3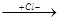
CH2=CH-CH-CH3 CH2-CH=CH-CH3 CH2-CH=CH-CH3 CH3-CH-CH=CH2
Cl Cl Cl Cl
Продукт присоединения продукт присоединения
HCl в положение 1,2 HCl в положение 1,4
3-хлор-1-бутен 1-хлор-2-бутен
Наблюдается резонанс 1 и 2 структур карбкатиона.
Выход продукта возрастает при повышении температуры, полярности и поляризуемости реагента.
2. Реакция диенового синтеза (реакция Дильса-Адлера) – реакция присоединения, характерная только для сопряженных диенов. Эта реакция используется для качественного и количественного определения сопряженных диенов под действием непредельных соединений (диенофилов), у которых двойная связь активирована электроноакцепторными заместителями благодаря сопряжению с электроотрицательными атомами.
Например:
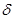 -
- 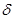 +
+
СH3 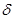 +CH2
+CH2 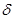 - CH2
- CH2
 C CH
C CH
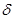 - CH
- CH 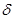 + +
+ + 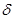 +C=O
+C=O 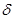 -
-
CH2 H
Изопрен акролеин
|
|
|

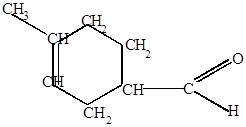
4-метил-3-циклогексенкарбальдегид
Роль диенофила могут выполнять и сами диеновые углеводороды (реакция Лебедева):
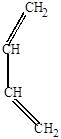
|
CH2
+СH-CH=CH2 
| 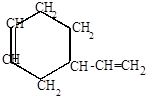
|
4-винил-1-циклогексен
2. Реакции окисления
Диены легко окисляются за счет активных двойных связей. Реакции идут так же, как у олефинов, за счет разрыва двойной связи.
1. Под действием озона:
СH2=CH-CH=CH2 + 2O3  CH2-CH-CH-CH2
CH2-CH-CH-CH2 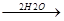 CH2 + CH-CH + CH2
CH2 + CH-CH + CH2
O-O-O O-O-O -H2O2 O O O O
2. Окисление молекулярным кислородом протекает:
а) с образованием перекисных олигомеров
 CH2=CH-CH=CH2 + O2
CH2=CH-CH=CH2 + O2  (-CH-CH2-O-O-)n
(-CH-CH2-O-O-)n
CH
CH2
 (-CH2-CH=CH-CH2-O-O-)n
(-CH2-CH=CH-CH2-O-O-)n
б) могут образовываться циклоперекисные продукты, здесь молекула кислорода работает как диенофил.
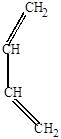
|
+ O  O
O
| 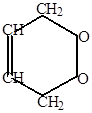
|
в) при высоких температурах и при наличии насыщенных звеньев может идти реакция окисления в a-звене.
H
CH2=CH-CH=CH-CH3 + O2  CH2=CH-CH=CH-CH
CH2=CH-CH=CH-CH 
H O-O-H
 H2O + CH2=CH-CH=CH-C
H2O + CH2=CH-CH=CH-C
O
Винилакролеин
3. Реакции полимеризации
Полимеризация диеновых углеводородов происходит в основном за счет 1,4-присоединения, хотя известны и 1,2-полимеры. Механизм реакций может быть ионным (металлические, металлорганические катализаторы) или свободно-радикальлным (в присутствии перекисного индикатора)

 (-CH2-CH=CH-CH2-)n 1 тип
(-CH2-CH=CH-CH2-)n 1 тип
СH2=CH-CH=CH2  (-CH2-CH-)n 2 тип
(-CH2-CH-)n 2 тип
CH=CH2
 (-(CH2-CH=CH-CH2)x-(CH2-CH))n
(-(CH2-CH=CH-CH2)x-(CH2-CH))n
CH
CH2 3 тип
III тип полимеризации наблюдается при использовании щелочных металлов в качестве катализатора. I и II тип полимеризации наблюдается при использовании катализатора Циглера.



 Пространственная структура полимеров, полученная в присутствии катализатора Циглера, отличается регулярностью повторения однотипных звеньев, такие полимеры называются стереорегулярными. При этом наблюдается несколько видов стереоизомерии. 1,4-стереорегулярные полимеры могут иметь цис- или транс-строение.
Пространственная структура полимеров, полученная в присутствии катализатора Циглера, отличается регулярностью повторения однотипных звеньев, такие полимеры называются стереорегулярными. При этом наблюдается несколько видов стереоизомерии. 1,4-стереорегулярные полимеры могут иметь цис- или транс-строение.
H H H CH2-
C=C C=C
-CH2 CH2- -CH2 H n
цис- транс-
1,2-стереорегулярные полимеры могут быть изотактическими или синдиотактическими.
CH2
CH
(-СH2-CH-)n (-CH2-CH-CH2-CH-)n
CH CH
CH2 CH2
изотактический синдиотактический
|
|
|
Нестереорегулярные полимеры – атактические с беспорядочным расположением ответвлений.
Полимеры диеновых углеводородов представляют собой очень эластичные каучукообразные вещества и применяются как заменители или синтетические аналоги натурального каучука в производстве резиновых изделий.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 301; Нарушение авторских прав?; Мы поможем в написании вашей работы!