КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні положення кінетичної теорії газів
|
|
|
|
Характеристика агрегатних станів речовини
Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
Основні питання:
1. Агрегатні стани речовини, їх загальна характеристика.
2. Ідеальний газ, основні закони ідеального газу.
3. Реальні гази. Рівняння Ван-дер-Ваальса.
4. Зрідження газів. Застосування зріджених газів.
Залежно від зовнішніх умов речовина може перебувати в трьох основних станах: твердому, рідкому, газоподібному. Можливі інші стани: рідкокристалічний, плазмовий, нейтронний, гіперонний тощо. Кожний агрегатний стан відрізняється від іншого характером руху частинок і типом взаємодії між ними. Стабільність агрегатного стану пов’язана зі співвідношенням кінетичної (Ек) та потенціальної (Ер) енергії взаємодіючих частинок.
| Агрегатний стан речовини | Співвідношення Ек і Ер частинок | Об’єм | Форма | Стисливість | Густина |
| Газоподібний | Ек > Ер | Співпадає з об’ємом посудини, залежить від температури і тиску | Заповнює посудину, приймаючи його форму | Висока | Низька |
| Рідкий | Ек = Ер | Фіксований | Нефіксована - повністю або частково заповнюють посудину | Незначна | Від помірної до великої |
| Твердий | Ек < Ер | Фіксований | Фіксована | Практично відсутня | Значна |
Характерна особливість газоподібного стану – вільний рух частинок (атомів, молекул) в об’ємі, що значно перевищує об’єм самих частинок.
Сили міжмолекулярної взаємодії виявляються, коли молекули наближаються одна до одної на достатньо близьку відстань.
Це зумовлює:
ü невелику густину газів;
ü здатність до безмежного розширення;
ü створення тиску на стінки посудини, що чинить опір;
ü істотні відмінності властивостей при високих тисках і низьких температурах.
|
|
|
Термін „газ” запроваджений датським вченим Дж.Ван Гельмонтом (1577 – 1644), означає „хаос” (від грецького слова).
Ідеальний газ – це газ, що знаходиться в такому стані, де можна нехтувати силами міжмолекулярної взаємодії та об’ємом молекул цього газу. Це спрощена модель реального газу.
Газові закони – математичні співвідношення між температурою, тиском та об’ємом газів (цілком точні для ідеального газу, а для реального – тільки при дуже малих тисках). Фізичний стан ідеального газу визначається трьома параметрами: Т, Р, V, які зв’язані між собою в рівняння стану ідеального газу.
Кінетична теорія газів – математична модель ідеального газу, яка дає змогу визначити поведінку газів і закони газового стану.
Виходячи з кінетичних уявлень про будову матерії, М.В.Ломоносов (1749р.) доповнив положення кінетичної теорії газів.
1. Газ складається з частинок дуже мізерного об’єму (об’ємом частинок можна нехтувати), які не взаємодіють між собою (крім зіткнень). Потенціальна енергія частинок ідеального газу дорівнює нулю та траєкторія їх руху ‑ лінійна.
2. Частинки газу безперервно та хаотично рухаються (Р,Т – зумовлені рухом частинок). Середня швидкість їх поступового руху при Т= const постійна, і вони рівномірно заповнюють наданий об’єм.
3. Між частинками газу відсутні сили притягання.
4. Частинки газу – ідеально пружні, тому їх зіткнення не супроводжуються втратою кінетичної енергії.
Т – статистичний сумарний ефект руху всіх частинок газу; Р – результат зіткнень частинок газу зі стінками посудини;
Т↑, υ↑, А↑ (частота зіткнень), Р↑.
5. Середня кінетична енергія частинок газу пропорційна його абсолютній температурі (Т↑, Ек↑, υ↑).
Еповна = U + (Ек + Ер) системи

(Ек + Ер)частинок
Ер – потенціальна енергія, зумовлена силами притягання (відштовхування) між частинками.
|
|
|
Ек – кінетична енергія (енергія поступального, коливального обертального руху частинок)
6. При зіткненнях енергія окремих частинок змінюється, проте сумарна енергія всіх частинок залишається постійною.
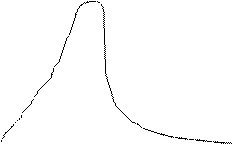
 Т2> Т1 Т2> Т1
% молекул
Т2 Т1
0 V | Статистичний закон розподілу Максвелла-Больцмана (1871). Криві розподілу молекул газу за швидкостями для двох температур: Т1<Т2 – графічний вираз закону. Максимум зміщується з підвищенням температури в бік більших швидкостей (найбільш імовірна швидкість). ü Чим вища температура, тим більша середня швидкість молекул; ü Розподіл молекул стає більш широким; ü Відносне число молекул зі швидкостями, близькими до середньоквадратичної, зменшується. |
| Рівняння кінетичної теорії газів | |||
| Рівняння | Математичний вигляд | Пояснення | Примітка |
| Основне рівняння кінетичної теорії газів (Клаузіус, 1857) | рV = 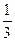 Nmυ2 Nmυ2
| m – маса частинки; N – число частинок; р – тиск газу; V ‑ об’єм газу; υ2 – квадрат середнього значення швидкості. | Дозволяє обґрунтувати газові закони, встановити зв'язок між мікроскопічними та макроскопічними властивостями ідеального газу. Обчислити швидкість і кінетичну енергію частинок газу. |
Рівняння середньоквадратичної швидкості частинок газу
(υср-кв =  ). ).
| υср-кв = 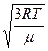
| Т – абсолютна температура; μ – молярна маса газу; R – універсальна газова стала 8,31Дж/моль∙К; υср=кв – середньоквадратична швидкість. | З підвищенням температури зростає швидкість руху молекул; За однакової температури швидше рухаються молекули з меншою масою. |
| Рівняння кінетичної енергії частинок газу | Ек = 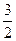 RT RT
| Ек – кінетична енергія; Т – абсолютна температура; R – універсальна газова стала. | З підвищенням температури зростає кінетична енергія частинок. |
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 391; Нарушение авторских прав?; Мы поможем в написании вашей работы!