
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферні розчини
|
|
|
|
Вплив рН середовища на перебіг технологічних і ферментативних процесів
| Технологічні процеси: ü Хлібопечення (в кислому середовищі) – збільшується ступінь набухання білків борошна (додають кислоту в листкове тісто); ü Освітлення желе для жельованих страв – підкислюють для осадження білків (руйнування гідратних оболонок між молекулами білків викликає втрату іонного стабілізатора, частинки злипаються, осаджуються); ü „згортання” молока в кислому середовищі; ü маринування овочів, плодів, грибів (додавання оцтової кислоти, цукру, прянощів); ü маринування м’яса перед тим, як жарити, використання кислих соусів для тушкування – в кислому середовищі відбувається розщеплення колагену та його частина – проколаген – добре розчиняється в кислому середовищі, крім того кислота прискорює процес переходу колагену в глютин; ü корозійна стійкість інвентарю зменшується в кислому середовищі. | Ферментативні процеси (відбуваються при певних значеннях рН): ü Шлунковий сік має значення рН=1,5 – 2,5. HCl необхідна для активізації шлункового ферменту пепсиногена у пепсин, який гідролізує у молекулах білків пептидні зв’язки, утворені карбоксильними групами ароматичних амінокислот, пептидні зв’язки, утворені лейцином, дикарбоновими амінокислотами з утворенням поліпептидів. ü В дріжджовому тісті відбувається процес утворення молочної кислоти (спиртове, молочнокисле бродіння), яка сприяє набуханню клейковини в борошні. ü Квасіння овочів – базується на утворенні молочної кислоти в результаті бродіння сахарів. Роль молочної кислоти: ▪ надання специфічного приємного смаку; ▪ зберігання вітаміну С; ▪ запобігання розвитку патогенної мікрофлори. ü Підвищення кислотності молока внаслідок молочнокислого бродіння (призводить до порушення сольового балансу молока, що негативно спливає на його термостійкість). ü Рівень кислотності сиру впливає на консистенцію та рисунок сиру. Для утворення нормального рисунку рН сиру повинна бути в межах 5,3 ‑ 5,9. При рН<5, рисунок не утворюється, деколи появляється дефект „самокол”. |
(здатні зберігати значення рН при розведенні або при додаванні невеликих кількостей кислоти чи лугу)
| Розчини, що містять слабку кислоту і сіль цієї кислоти з сильною основою (рН=4-7) | Розчини, що містять слабку основу і сіль цієї основи з сильною кислотою (рН=7-10) | Розчини, що містять солі багатоосновних слабких кислот рН=7,35-7,45 | ||
| ▪ СН3СООН + СН3СООNa ▪ NaНСО3 + Н2СО3 ü У водному розчині: СН3СООNa → СН3СОО- + Na+ NaНСО3 → Na+ + НСО3- (дисоціація солей) Часткова дисоціація слабких кислот: СН3СООН +Н2О ↔ СН3СОО- + Н3О+ Н2СО3 + Н2О↔НСО3- + Н3О+ ü При додаванні кислоти (Н3О+): рівновага зміщується ліворуч, відновлюється рН. СН3СОО- + Н+↔СН3СООН ü При додаванні кислоти (HCl): Н3О+ + НСО3-→Н2СО3 + Н2О (Надлишкова концентрація Н+ нейтралізується взаємодією з НСО3-). Надлишок Н2СО3 гідролізується у присутності ферменту карбоангідрази: Н2СО3↔ СО2 + Н2О СО2 вилучається через легені. | ▪ NH4OH + NH4Cl ü У водному розчині: NH4Cl→ NH4+ + Cl- (повна дисоціація солі). NH4OH ↔ NH4+ + ОН- (часткова дисоціація). ü При додаванні кислоти: Н3О+ + NН3Н2О → 2Н2О + NН4+ (нейтралізація кислоти іонами ОН-, [ОН -]=const, рН=const ü При додаванні лугу: рівновага при дисоціації аміаку зміщується ліворуч, [ОН-]=const NH4+ + ОН-↔ NH4OH (ОН- зв’язуються з іонами NH4+, утвореними в результаті дисоціації солі, рН=const). | ▪ Na2HPO4 + NaH2PO4 ü У водному розчині: Na2HPO4↔ 2Na+ + HPO4- NaH2PO4↔ Na+ + H2PO4- Між гідрофосфат- і дигідрофосфат-іонами встано-влюється рівновага: НРО42- + Н3О+ ↔Н2РО4- + Н2О НРО42- + Н2О ↔Н2РО4- + ОН- ü При додаванні кислоти: НРО42- (аніон дуже слабкої кислоти, акцептор іонів Н3О+) зв’язує іони водню сильної кислоти з утворенням Н2РО4- НРО42- + Н3О+ →Н2РО4- + Н2О ü При додаванні лугу: Н2РО4- + ОН-→ НРО42- + Н2О | ||
ü При додаванні лугу:
Н3О+ + ОН- → 2Н2О
Нейтралізація іонами Н3О+ гідроксид-іонів, рівновага в реакції дисоціації кислоти зміщується праворуч, рН-const
СН3СООН + NaОН → СН3СООNa + Н2О.
При надходженні лужних продуктів – кисла частина буферної системи нейтралізує луг:
Н2СО3 + ОН-→НСО3- + Н2О
НСО3- ‑ виводиться нирками.
Висновки:
▪ Аніони, утворені в результаті повної дисоціації солі, повністю пригнічують дисоціацію слабкої кислоти.
▪ При додаванні сильної кислоти її водневі іони з’єднуються з аніонами слабкої кислоти з утворенням недисоційованих молекул кислоти (рН=const)
▪ При додаванні лугу: гідроксид-іони взаємодіють з іонами водню (або молекулами к-ти) з утворенням води (рН=const)
рН=рКа + lg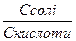
| Висновки:
▪ Катіони, утворені в результаті повної дисоціації солі, повністю пригнічують дисоціацію слабкої основи.
▪ При додаванні сильної кислоти її іони водню зв’язуються з слабкою основою з утворенням води, рН-const.
▪ При додаванні лугу його гідроксид-іони зв’язуються з катіонами слабкої основи з утворенням недисоційованих молекул основи, рН-const
рН=14 – рКв + lg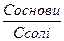
| Висновки:
▪ НРО42- + Н+ОН- → Н2РО4- +ОН-;
▪ При додаванні кислоти:
НРО42- зв’язують іони Н+ (рівновага зміщується праворуч, утворюються Н2РО4-);
▪ При додаванні лугу:
Н2РО4- зв’язують іони ОН- (рівновага зміщується ліворуч, утворюються НРО42-).
рН = рКн2ро4- ‑ lg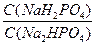
| ||
Таким чином, рН буферного розчину певного складу визначається відношенням концентрації кислоти і солі або основи і солі (не залежить від розведення).
При зміні об’єму розчину концентрація кожного компоненту змінюється в однакове число раз і їх співвідношення залишається сталим.
Буферна суміш підтримує сталим значення рН за умови: кількість доданих до розчину кислоти або основи не перевищує граничної величини (буферна ємність).
Здатність буферних розчинів протидіяти зміні рН – буферна дія.
Межі, в яких проявляється буферна дія, називається буферна ємність (кількість моль еквівалентів сильної кислоти або сильної основи, що треба додати до 1л буферного розчину для зміни рН середовища на одиницю).
Буферна ємність залежить від:
a природи і концентрації компонентів буферного розчину;
a співвідношення концентрацій компонентів.
Чим більша концентрація компонентів, чим ближче співвідношення концентрацій: кислота – сіль, основа – сіль до одиниці, тим більша буферна ємність.
 |
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 661; Нарушение авторских прав?; Мы поможем в написании вашей работы!