
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекулярний режим
|
|
|
|
Молекулярний режим ще називають режимом Кнудсена. Число Кнудсена відповідає нерівності 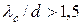 . Для повітря при 25
. Для повітря при 25 С молекулярний режим буде визначатися такою нерівністю
С молекулярний режим буде визначатися такою нерівністю
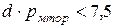 [ м Торр
[ м Торр  см ]. (5.10)
см ]. (5.10)
При молекулярному режимі середня довжина вільного пробігу молекул більша за діаметр трубопроводу, тому сила, що виникає від дії різниці тисків, буде дорівнювати
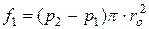 ,
,
а гальмуюча сила - імпульсу, що переноситься до стінок за одиницю часу всіма молекулами, які будуть ударятися в стінку:
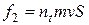 .
.
Після підстановки виразів для 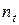 і S будемо матимемо
і S будемо матимемо
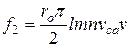 . (5.11)
. (5.11)
Рівновага цих сил відповідає рівнянню
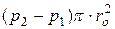
 ,
,
за допомогою якого можна встановити, що швидкість переміщення газу не змінюється залежно від радіуса трубки, тобто стала в будь-якій точці поперечного перерізу

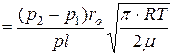 . (5.12)
. (5.12)
При визначенні об’ємної витрати газа слід врахувати, що не всі молекули будуть ударятися в стінку тільки перпендикулярно, тоді
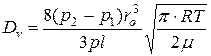 , (5.13)
, (5.13)
а масова витрата (в одиницях маси)
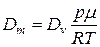
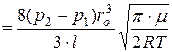 . (5.14)
. (5.14)
5.5. Порівняння двох режимів течії газу
В обох режимах масова витрата газу пропорційна різниці тисків і обернено пропорційна довжині трубки.
Між режимами існують такі відмінності:
а) при в’язкісному режимі потік газу пропорційний четвертому ступеню радіуса трубки, тоді як при молекулярному режимі - третьому ступеню;
б) залежність від середнього тиску спостерігається тільки при в’язкісному режимі, тобто потік газу при молекулярному режимі не залежить від середнього тиску в трубопроводі;
в) залежність від молекулярної маси і температури газа більша при в’язкісному режимі, ніж при молекулярному.
Отримані залежності використовують при розрахунках вакуумних систем.
5.6. Перепускна властивість вакуумпроводів
|
|
|
Витрата газу, як зазначено вище, завжди пропорційна різниці тисків, під дією якої виникає потік, тому можна визначити коефіцієнт пропорційності як

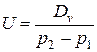 [ м
[ м 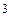 / с ],
/ с ],
де витрата газу виражена в одиницях pV / c.
Величину 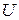 , що характеризує витрату газу при одиничній різниці тисків, називають перепускною властивість або провідністю трубопровода. Очевидно, що провідність залежить від режиму течії газу і визначається геометричними характеристиками трубопровода.
, що характеризує витрату газу при одиничній різниці тисків, називають перепускною властивість або провідністю трубопровода. Очевидно, що провідність залежить від режиму течії газу і визначається геометричними характеристиками трубопровода.
5.6.1. Провідність вакуумпроводів (в’язкісний режим)
для довгого (l /r >20) циліндричного трубопровіду
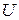
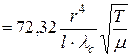 [ м
[ м 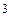 / с ]; (5.15)
/ с ]; (5.15)
для круглого отвору з площею S (газ - повітря при 20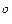 С)
С)
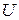
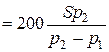 [ м
[ м 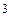 / с ]. (5.16)
/ с ]. (5.16)
5.6.2. Провідність вакуумпроводів (молекулярний режим)
для довгого циліндричного трубопровіду
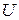
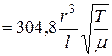 [ м
[ м 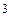 / с ]; (5.17)
/ с ]; (5.17)
для короткого(l /r <20) циліндричного трубопроводу (газ - повітря при 20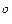 С)
С)
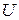
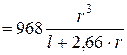 [ м
[ м 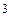 / с ]; (5.18)
/ с ]; (5.18)
для круглого отвору радіусом r (газ - повітря при 20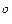 С)
С)
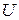
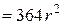 [ м
[ м 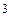 / с ]. (5.19)
/ с ]. (5.19)
5.6.3. Провідність вакуумпроводів (в’язкістно - молекулярний режим)
В’язкісно - молекулярний режим відповідає середньому вакууму. Для визначення провідності в цьому режимі використовують провідності в’язкісного і молекулярного режимів за напівемпіричною формулою, яку запропонував Кнудсен
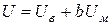 , (5.20)
, (5.20)
де коефіцієнт b залежить від тиску і змінюється в межах від 0,8 до 1;
для довгого циліндричного трубопровіду (газ - повітря при 20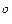 С)
С)
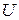
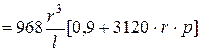 [ м
[ м 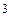 / с ]. (5.21)
/ с ]. (5.21)
У наведених формулах довжина і радіус трубки подані в метрах.
Запитання для самоперевірки
1. За якими параметрами можна розрізняти ступені вакууму?
2. Що називають числом Кнудсена?
3. Які режими течії газу розрізняють?
4. Які відмінності мають в’язкісний і молекулярний режими течії газу?
5. Дайте визначення провідності вакуумпроводу, наведіть параметри, від яких вона залежить.
Лекція шоста
ОСНОВНІ ВИЗНАЧЕННЯ ФІЗИКО-ХІМІЧНИХ ЯВИЩ ПРИ НИЗЬКИХ ТИСКАХ ОТОЧУЮЧИХ ГАЗІВ
|
|
|
6.1. Визначення переходів між фізичними станами речовини. Тиск насиченої пари
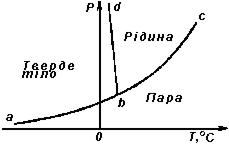 Рис. 6.1.
Рис. 6.1.
|
Відомо, що речовина може бути в чотирьох різних агрегатних станах: твердому, рідкому, газоподібному і як плазма. Перехід з одного стану в інший виникає при сумістній дії тиску та температури і має такі назви: плавлення - якщо тверда речовина перетворюється в рідину; сублімація або випарювання - тверда речовина перетворюється в пару; пароутворення або випарювання - рідка речовина перетворюється в пару; затвердіння - рідка речовина перетворюється в тверду; скраплення або конденсація - газ перетворюється в рідину; конденсація або десублімація - пара перетворюється в тверду речовину. Ці перетворення ілюструються наведеною на рис. 6.1 діаграмою станів, яку називають сім’єю кривих, що зображують фізичні перетворення речовини залежно від тиску і температури. На діаграмі крива abc зображує залежність тиску насиченої пари від температури, а пряма bd - залежність температури плавлення від тиску. Точка c, якою закінчується крива abc, називається критичною точкою, а температура, що їй відповідає, - критичною температурою, точка b, де обидві залежності сходяться, називається трійчатою точкою. Як видно на рисунку, якщо тиск і температура речовини мають значення, що відповідають області, обмеженій лініями ab і bd, то речовина знаходиться в твердому стані; в межах bd і bc - в рідкому; нижче abc - в газоподібному (пара); з температурою вище критичної - в стані газу. Таким чином, можна критичну температуру визначити як температуру, вище якої речовина завжди знаходиться в стані газу і ніяким тиском її неможливо перевести в інший будь-який стан. Слід відмітити такі особливості перехідних процесів:
а) підтримуючи відповідні температуру і тиск, можна здійснити невизначений стан одночасного існування речовини в двох станах, наприклад, в стані твердого тіла і пари, або рідини і пари.
б) якщо тіло розмістити в замкненому просторі, то воно буде випаровуватися доти, поки при визначеній температурі тиск його пари не досягне величини на кривій abc. Починаючи з цього моменту тіло буде знаходитися у рівновазі зі своєю парою, яка в цьому випадку називається насиченою, а тиск - тиском насиченої пари (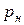 ). Тиск насиченої пари ще називають пружністю пари. Пара, що не досягла тиску насичення, називається сухою парою.
). Тиск насиченої пари ще називають пружністю пари. Пара, що не досягла тиску насичення, називається сухою парою.
|
|
|
в) у трійчатій точці має місце невизначений стан існування речовини в трьох станах одночасно;
г) можна так вибрати температуру і тиск, що тверда речовина перетвориться в пару (сублімується), або його пара конденсується, не перетворюючись в рідину. Останню властивість використовують у вакуумній техніці для отримання вакууму;
д) криву abc, тобто залежність тиску насиченої пари від температури можна описати таким приблизним рівнянням
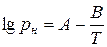 , (6.1)
, (6.1)
де А і В - сталі величини, характерні для даної речовини і мають табличні значення.
Залежність тиску насиченої пари, або, як ще кажуть, пружності пари різних речовин від температури часто наводиться графічно, як зображено на рис. 6.2.
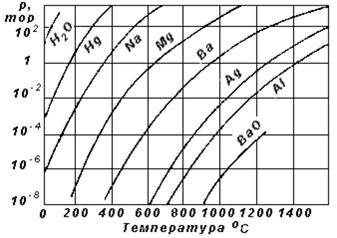
Рис. 6.2.
Пружності насиченої пари різних речовин, що використовуються у вакуумній техніці, дуже відрізняються при одній і тій же температурі, як це видно з рис. 6.2. Пружність пари твердих тіл значно нижча, ніж у рідини, але для всіх речовин тиск пари з температурою зростає майже експонеціально, що є підтвердженням правомірності застосування емпіричної формули (6.1).
6.2. Швидкість випарювання або сублімації речовини
Насичення пари виникає, коли число молекул, які випарились буде дорівнювати числу молекул, що конденсувались, тобто настане рівновага. Але якщо над нагрітою речовиною створити і підтримувати вакуум, то рівновага порушиться, оскільки пара буде видалятись в мірі її виникання. Використовуючи рівняння для числа молекул, що бомбардують одиницю площі стінки за одиницю часу, а також вираз для середньої арифметичної швидкості молекул, можна визначити масу молекул, які випарюються за одиницю часу. Тобто швидкість випарювання 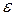
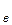 , буде дорівнювати
, буде дорівнювати
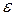
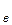
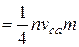
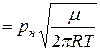 . (6.2)
. (6.2)
Оскільки при створенні вакууму не завжди можливо досягнути того, щоб над речовиною не виникав залишковий тиск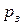 її пари, то швидкість випарювання зменшиться і дорівнюватиме:
її пари, то швидкість випарювання зменшиться і дорівнюватиме:
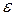
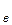
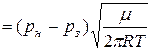 . (6.3)
. (6.3)
|
|
|
При високому вакуумі, використовуючи формулу (6.3), можна оцінити масу речовини, що випариться з одиниці площі за одиницю часу, якщо буде відома температура і тиск у стані рівноваги.
6.3. Закономірності насиченої пари
Поведінка насиченої пари не підлягає опису законами для ідеального газу і має такі закономірності:
а) тиск насиченої пари залежить тільки від температури і з її підвищенням зростає майже експоненціально;
б) у різних речовин тиск насиченої пари при одній і тій же температурі дуже відрізняється: летючі речовини(ефіри, спирти, вода,...) мають більший тиск пари, а тиск пари твердих речовин значно нижче, але незважаючи на це, навіть низький тиск таких твердих речовин, як гума, вакуумна замазка та ін., що використовуються як ущільнювачі, може значно погіршити можливість досягнення високого вакууму;
в) швидкість випарювання при даній температурі буде меншою, якщо випарювання буде відбуватися не у вакуумі, а в середовищі іншого газу;
г) якщо над поверхнею речовини тиск її пари нижче за тиск насиченої пари при даній температурі, то явище випарювання буде відбуватися і припиниться тільки тоді, коли ці тиски вирівняються, тобто коли настане динамічна рівновага між випарюванням і конденсацією.
6.4. Особливості конденсації
Явище, обернене випарюванню, тобто перетворення газу або пари в рідину, називається конденсацією. Ці два явища широко використовуються у вакуумній техніці для нанесення тонких плівок на різні поверхні, для уловлювання небажаної пари різних речовин, для дистиляції (очищення) різних рідин.
Конденсація виникає тоді, коли тиск пари речовини буде більший за тиск насиченої пари, тобто коли конденсуватися будуть більше молекул, ніж випарюватися.
6.4.1. Принцип холодної стінки
Якщо в замкнутому об’ємі, де знаходиться речовина і її насичена пара, проводити достатньо енергійне охолодження якоїсь частини стінки, де знаходиться пара, то на охолодженій ділянці ця пара буде конденсуватися, тобто відбудеться дистиляція. Це явище пояснюється тим, що молекули пари, які потрапили на охолоджену ділянку, втрачають свою енергію і стають не в змозі відірватися від стінки, як відривалися тоді, коли стінка мала таку ж температуру, як і пара.
6.4.2. Використання явищ випарювання і конденсаціі у вакуумній техніці. Напилення тонких плівок твердої речовини
Випарювання різних матеріалів у вакуумі широко використовується у виробництві електровакуумних приладів, в оптичній промисловості і навіть для прикрашення різних речей. Цей спосіб має багато переваг у порівнянні з іншими. Плівка речовини, що напилюється на необхідну деталь виходить чистою і блискучою завдяки відсутності окислення. Товщина плівки може бути надзвичайно тонкою. Металеві покриття можна наносити на ізоляційні матеріали і навпаки.
6.4.3. Дистиляція у вакуумі
Дистиляція викортстовується для очищення речовин шляхом фракційного (складового) розгону. Легкі фракції, що входять до складу речовини, після нагрівання випарюються першими і відкачуються вакуумними насосами, а очищена речовина конденсується після проходження через охолоджувач і збирається в додатковому резервуарі.
6.4.4. Дифузійні насоси
Пара робочої речовини, що нагрівається до кипіння, випускається зі звуженого отвору - сопла в напрямі охолоджувача, де конденсується і як рідина стікає знову до випарювача, тоді як молекули газу, що потрапили в струмінь, не можуть сконденсуватися і збираються біля випускного отвору, розміщеного в нижній частині охолоджувача. Завдяки такому процесу після видалення газу з підвищеним тиском, що створився в результаті такого перетікання з вакуумної камери до випускного отвору, досягається зниження тиска у вакуумній системі.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 296; Нарушение авторских прав?; Мы поможем в написании вашей работы!