
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экономика фирмы
|
|
|
|
0 +5 +4 +2
План.
1. Етіологія дитячих розладів.
2. Ґенеза та характеристика дитячих розладів.
3. Програма втручань.
1. Ненадійна прив’язаність. Це не психопатологія, а скоріше фактор ризику. Точніше стає таким фактором лише при взаємодії з іншими факторами ризику, такими як крайня бідність.
2. Надійна прив’язаність. Малюки вільно досліджують оточуюче середовище в присутності людини, яка про нього піклується. Відділення від неї може викликати в них тривожність, а може і не викликати, хоча в її відсутність діти, як правило, обмежують свою дослідницьку активність. Вони радісно вітають матір, яка щойно повернулася(або людину, яка піклується про них) або якщо знаходяться у стані стресу, то йдуть на контакт, швидко заспокояться і повернуться до дослідження. Біля 55% немовлят мають нормальну прив’язаність. Вданому випадку турбота дорослих відрізняється сенситивністю до потреб немовляти. Піклування відповідає потребам малюка, мати правильно доглядає за ним, реагує на нього адекватно та з позитивними емоціями.
3. Уникаюча прив’язаність. (20%). Передчасно досягнена незалежність. При розлуці з матір’ю рідко демонструють дистрес та ігнорують або уникають матір при поверненні. Хоча і здається, що немовля зайняте дослідженням, що викликають контакти з іншими людьми, насправді вони досліджують менше ніж діти з ненадійною прив’язаністю. Догляд за немовлям вирізняється стриманістю, холодністю та відсутністю втіхи у сукупності з роздратуванням і гнівом, що виникає під час близькості. Уникнення є спробою немовляти перемогти наслідки батьківської хворої поведінки.
4. Опираюча прив’язаність. (10%). Велика увага зосереджена на матері. Їх вкрай пригнічує розлука, але при возз’єднанні вони чинять опір при спробі зближення або демонструють амбівалентний патерн, який вміщує вимогу, щоб їх взяли на руки, після того зі злістю відштовхують турботливу людину. Зосередженість на матері суттєво обмежує дослідницьку активність малюка. Турбота дорослих вирізняється непередбачуваністю. Іноді матір дуже близька, іноді – безучасна або роздратована. Коріння цієї роздратованості – в нереально завищених очікуваннях матері, яка вважає, що вона може бути безмежно люблячою та всемогутньою в тому, що стосується власної дитини. Фрустрація таких очікувань відповідає реаліям турботи за малюком, знаходячи своє вираження в відстороненності та роздратуванні. Опір розцінюється як спроба малюка привернути увагу матері, в той час як гнів є наслідком фрустрації від непостійних турбот.
|
|
|
5. Дезорієнтована прив’язаність. (15%). Малюки поводяться у непослідовній манері. При розлуці, може бути подив або безцільне бродіння по кімнаті, а в присутності матері демонструють боязливість та амбівалентність не знаючи чи то звернутися до неї за підтримкою, чи то уникати. Тобто прослідковується відсутність чіткої стратегії поводження з матір’ю. Догляд за дитиною характеризується відсутністю чіткої мови сигналів, такі матері як правило, є самі налякані та заплутаними, очікують, що немовля буде задовольняти їх фрустровані потреби у втісі та захисті. Інакше кажучи відбувається інверсія ролі немовляти та ролі матері.
6. Контролююча поведінка. Даний патерн був зовсім нещодавно доданий до числа патернів ненадійної прив’язаності, скоріш за все він виник, як з патерну дезорієнтаційної прив’язаності в період початку ходіння, хоча й неообовязково замінює його. Ознаки: інверсія ролей, яка може виражатися негативно, у формі деспотичних вимог або ж позитивно у формі надтурботливості. Така поведінка характерна для дітей, батьки яких застосовують насилля фізичне. Можлива варіабельність патернів. Депривація турботи приводить до великої загальмованості, амбівалентності реакцій, збільшення настороженості.
|
|
|
Дифузна прив’язаність. Нерозбірлива компетентність або нездатність сформувати індивідуальну прив’язаність. Все це викликано або занедбаністю, або частою зміною людей, які піклуються про дитину.
Надійність. Емоційне ядро закладається у відчуванні себе у безпеці. Еволюція історії запрограмувала малюків на те, щоб асоціювати близькість до мами, як почуття надійності та безпеки, а відділення небезпеки та тривоги.
Досліджувана активність. Надає змогу на першому та другому році життя досліджувати оточуюче середовище з безпечної бази, ризикуючи вторгнутися у невідоме, але зберегти впевненість в тому, що у випадку небезпеки, мати надасть захист та втішить. В період початку ходіння прив’язаність посилює розвиток у собі автономії. Надійна прив’язаність протидіє першопочатковим почуттям інфантильної безпорадності, формується емоційна реакція та дитині у формі уявлення, що вони гідні любові. Ненадійна прив’язаність може призвести до відхилення від норми. Зв’язок між ненадійністю та послідуючими розладами був знайдений при проведенні дослідження на вибірках дітей, які виховувалися в умовах жебрацтва або хаотичному домашньому середовищі, але така кореляція на вибірках заниженого ризику не знайдено.
Опираюча прив’язаність. Призводить в подальшому до появи тривожних розладів (Убрен). Голдберг вказував на те, що кореляція між ненадійністю та прив’язаністю існує. Дезорієнтована прив’язаність не заключає в собі ризику виникнення в індивіда будь-яких порушень. Шоу вважає, що дезорієнтована прив’язаність призводить до агресії у 5 річному віці.
Опозиційно - викликаючий розлад. Охоплює періоди розвитку від раннього дитинства і включає в себе підлітковий вік. Основні терміни: «негативізм», «непокора», «опозиційність», «поведінка». Симптоми: спалахи гніву, викликаюча поведінка, причепливість, звинувачення інших у власних помилках, образливість, роздратування, нав’язливість. Однак на противагу від розладів поведінки, ОВР не викликає порушення прав інших людей або основних суспільних норм та правил. Це може виражатися у постійній брехні, агресивності, крадіжках. Дослідження ОВР мають розрізнений характер протиріч, що обумовлено віковими та статевими розбіжностями та різницею соціально-економічного статусу. Поширення ОВР – 2-16%.
|
|
|
Критерії ОВР: вказані симптоми зберігаються протягом 6 місяців. Дане порушення призводить до значного погіршення соціальних навичок або професійних функцій. Характеристики. В ранньому дитинстві ОВР частіше зустрічається у хлопчиків ніж дівчаток, але у підлітковому віці, це співвідношення змінюється на зворотне; крім того, відмічено, що ОВР поширений в групі з більш низьким соціально-економічним статусом (СЕС).
Коморбидність. ОВР та РП. Однак ОВР протікає більше в рамках сім’ї в той час, як РП – поза нею. Діти з ОВР мають менше патологічних відхилень ніж діти з РП. ОВР частіше виникає у дошкільному віці, РП – у середньому. Хоча у 90% РП передумовою був ОВР, однак 50% дітей з ОВР не переходять в РП. 25% дітей взагалі переростає ОВР. ОВР та СДУГ. (20%). – СДУГ збільшує ризик раннього розвитку ОВР. + РП = симптоми проявляються у важкій формі = має чітку кореляцію з серйозними порушеннями в особистісній, міжособистісній та емоційній сферах. ОВР та НН. – прямо вони не пов’язані, але вона обумовлюється наявністю СДУГ як коморбідного розладу.
Фактори ризику: антисоціальна поведінка батьків, невиконання ними батьківських обов’язків, окреме проживання батька, відсутністю контролю з боку батьків.
Етіологія: коріння ОВР криються у нормальній поведінці. Мова про патологію йде лише тоді, коли має місце збільшення частоти та інтенсивності симптомів. Генетичні фактори відіграють другорядну роль. Є кореляція між ненадійною прив’язаністю та ОВР.
Батьківська поведінка: матері дітей з ОВР є занадто контролюючими та агресивними, в той час як батько – пасивний та холодний. Мати налаштована на дитину критично-негативно, характерна загрозлива, неупереджена поведінка. Батьки надають багато наказів та інструкцій, не залишаючи часу на їх виконання.
|
|
|
Втручання:
· Аналіз усвідомлених та неусвідомлених почуттів особливо тих, що включає проблему автономії та контролю;
· Зміна техніки батьківського спілкування;
· Перехід на альфа-вказівки (чіткий контроль);
· Оперантність навчання;
Енурез:
- види – нічний, денний, денно-нічний. Первинний та вторинний енурез.
З 11 років кількість хлопчиків переростає кількість дівчаток. Більш поширений в сім’ях з низьким соціально-економічним статусом, є залежність від расово-етнографічних груп.
Етіологія: вторинний енурез є реакцією на стрес і обумовлений рядом органічних факторів.
Втручання: мозковий будильник, тренінг сухого ліжка.
3Si + 4НNО3 + 18НF = 3Н2SiF6 + 4NО + 8Н2O
В этой реакции НNО3 играет роль окислителя, а НF комплексообразующей среды. В результате реакции кремний переходит в устойчивую степень окислений +4; входит в состав устойчивого фторокомплекса SiF62-.
Кремний энергично растворяется в щелочах с выделением водорода:
0 +1 +4 0
Si + H2O + 2KOH = K2SiO3 + 2H2
При этом роль окислителя выполняет вода, а комплексообразующей среды — ОН- -ионы.
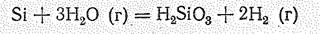 С водой в обычных условиях кремний не реагирует, но при высоких температурах происходит процесс
С водой в обычных условиях кремний не реагирует, но при высоких температурах происходит процесс
Окислительная активность кремния проявляется лишь по отношению к некоторым металлам, например:
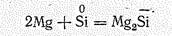
Кремний технической чистоты (95—98 %) получают в электропечах восстановлением SiО2 с помощью кокса. В лаборатории в качестве восстановителя применяют магний. При этом образуется сильно загрязненный примесями коричневый порошок кремния. Последний перекристаллизацией из металлических расплавов (Zn, Аl и др.) можно перевести в кристаллическое состояние. Необходимый для полупроводниковой техники кремний особой чистоты получают восстановлением SiСl4 цинком при высокой температуре:
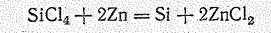
а также термическим разложением его водородных соединений или SiI4:

Дополнительно очищают кремний зонной плавкой. Монокристаллы кремния с соответствующими добавками служат для изготовления различных полупроводниковых устройств (выпрямителей переменного тока, фотоэлементов и пр.). Из кремниевых фотоэлементов (преобразователи световой энергии в электрическую), в частности, построены солнечные батареи, обеспечивающие питание радиоаппаратуры на космических аппаратах.
Кроме полупроводниковой техники кремний широко применяется в металлургии для раскисления сталей и придания им повышенной коррозионной стойкости. Для этих целей используется сплав кремния с железом (ферросилиций), получаемый при совместном восстановлении коксом железной руды и кремнезема. Ферросилиций очень устойчив к действию кислот и потому используется для изготовления кислотоупорных изделий.
Соединения с отрицательной степенью окисления кремния. При окислении металлов кремнием (700—1200 °С) или при нагревании смеси соответствующих оксидов и кремния в инертной атмосфере образуются силициды (но в большинстве случаев валентные соотношения остаются неясными):
2Mn + Si = Mn2Si
6MnO + 5Si = 2Mn3Si + 3SiO2
Силициды применяют для получения жаростойких и кислотоупорных сплавов и в качестве высокотемпературных полупроводниковых материалов. Из дисилицида молибдена МоSi2, выдерживающего нагрев до 1600—1700 °С в агрессивной атмосфере, изготовляют нагреватели электропечей. Ряд силицидов f-элементов применяется в атомной энергетике в качестве поглотителя нейтронов и т. д.
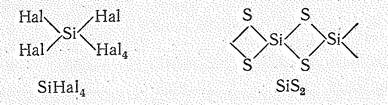
Соединения кремния (IV). Кремний находится в степени окисления +4 в соединениях с галогенами, кислородом и серой, азотом, углеродом, водородом, Рассмотрим некоторые его бинарные соединения: SiНаl4, SiO2, SiS2, Si3N4, SiС, SiН4. Поскольку устойчивое к оординационное ч исло кремния 4, мономерными являются лишь SiНаl4 и SiН4, остальные соединения полимерны. Структурной единицей подавляющего большинства соединений Si (IV) являются тетраэдры из более электроотрицательных атомов (SiO4, SiS4, Si3N4, SiС4) с атомом Si в центре. В плоскостном изображении показаны структуры SiНаl4 и SiS2
Полимерные соединения с координационной решеткой (SiO2, SiС) характеризуются высокой температурой плавления и химической устойчивостью.
Мономерные соединения, наоборот, легкоплавки, химически активны. Промежуточное положение занимают соединения с цепной структурой (SiS2).
Отвечающие бинарным соединениям анионные комплексы кремния (IV) SiO32-, SiS32-, SiN22- в отличие от таковых углерода (IV) в подавляющем большинстве также полимерны.
Таким образом, имея одинаковое число валентных электронов, углерод и кремний образуют соединения одинакового состава. Однако по строению, а следовательно, и по химической активности однотипные соединения углерода и кремния существенно отличаются.
По химической природе бинарные соединения Si (IV) являются кислотными. Так, большинство из них взаимодействует со щелочами (в растворах и особенно при сплавлении):

и с другими основными соединениями:
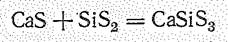
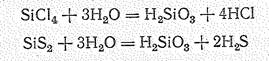 При гидролизе они образуют кислоты:
При гидролизе они образуют кислоты:
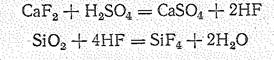 Галогениды SiНаl можно получить непосредственным взаимодействием простых веществ. Тетрафторид обычно получают действием концентрированной серной кислоты на смесь SiO2 + СаF2:
Галогениды SiНаl можно получить непосредственным взаимодействием простых веществ. Тетрафторид обычно получают действием концентрированной серной кислоты на смесь SiO2 + СаF2:
а тетрахлорид при нагревании смеси SiO2 и углерода в атмосфере хлора.
Значительные количества SiF4 получаются как побочный продукт суперфосфатного производства.
В обычных условиях SiF4 — газ, SiСl4 и SiВr4 — жидкости, SiI4 — твердое вещество. Все они бесцветны.
В противоположность тетрагалогенидам углерода тетрагалогениды кремния гидролизуются очень легко. Гидролиз протекает по ассоциативному механизму за счет последовательного присоединения молекул воды и отщепления молекул ННаl, вплоть до образования Si(ОН)4.
Так, гидролиз SiСl4
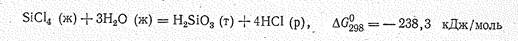
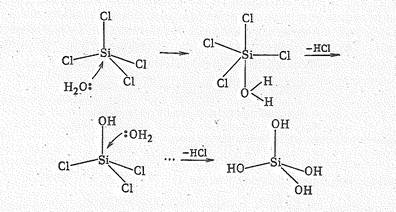 можно представить следующей схемой:
можно представить следующей схемой:
Молекулы Н4SiO4 далее полимеризуются с образованием продукта условного состава Н2SiO3. Вследствие гидролиза тетрагалогениды кремния во влажном воздухе дымят.
Повышение координационного числа кремния (IV) с 4 до 5 в промежуточном соединении можно объяснить возникновением трехцентровой связи. Так, в SiСl4×Н2O три атома хлора связаны с атомом кремния посредством двухцентровьгх связей, а один атом хлора и молекула воды посредством трехцентровой связи.
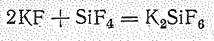 В отличие от других галогенидов Si (IV) кислотная природа SiF4 проявляется не только при гидролизе, но и при взаимодействии с основными фторидами, например:
В отличие от других галогенидов Si (IV) кислотная природа SiF4 проявляется не только при гидролизе, но и при взаимодействии с основными фторидами, например:
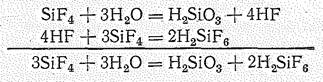 Вследствие устойчивости, гексафторосиликат-иона SiF62- гидролиз SiF4 выражается уравнениями:
Вследствие устойчивости, гексафторосиликат-иона SiF62- гидролиз SiF4 выражается уравнениями:
Гексафторосиликат водорода Н2SiF6 в свободном состоянии не выделен. В водном растворе Н2SiF6 — сильная (типа Н2SО4) гексафторокремневая кислота.
Фторосиликаты металлов получают действием плавиковой кислоты на смесь кремнезема и соответствующего фторида:
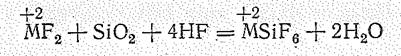
Большинство фторосиликатов растворимо в воде. Малорастворимы производные щелочных металлов (кроме лития) и бария. Наибольшее значение имеет Nа2SiF6. Применяют его для фторирования воды, как инсектицид, в производстве кислотоупорных цементов, эмалей и пр. Тетрафторид кремния и все фторосиликаты ядовиты.
Кроме мономолекулярных выделены гомоцепные фториды и хлориды гомологического ряда SinНаl2n+2, а также некоторые циклические производные. Длина гомоцепи —Si—Si— не превышает 10 атомов (Si10Н22). Гомоцепные олигомеры кремния в противоположность аналогичным соединениям углерода легко разлагаются и химически активны.
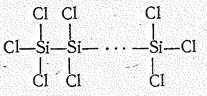
Гомоцепи — Si — Si — обнаруживаются в гидридах кремния (силанах) гомологического ряда SinН2n+2. По составу (SiН4, Si2Н6, Si3Н8, Si4Н10 до Si6Н14) и физическим свойствам силаны сходны с соответствующими углеводородами. В обычных условиях моносилан SiН4 и дисилан Si2Н6 газообразны, трисилан Si3Н8 — жидкость, высшие представители гомологического ряда — твердые вещества.
Поскольку связи Si—Н и Si—Si слабее связей С—Н и С—С, кремневодороды несравненно менее устойчивы и более реакционноспособны, чем соответствующие углеводороды. Большинство из них на воздухе самовоспламеняется. Сгорают силаны с большим выделением тепла, например:
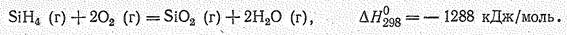
С галогенами силаны взаимодействуют со взрывом. Силаны — кислот- ные гидриды, о чем свидетельствует характер их взаимодействия со щелочами. При этом разложение силанов происходит активно даже в присутствии следов щелочи. В кислой среде кремневодороды довольно устойчивы. С водой реагируют при комнатной температуре:
SiO2 + 3H2O = H2SiO3 (SiO2×xH2O) + 4H2.
С водородом кремний непосредственно не взаимодействует. Силаны получают косвенным путем, например действием кислот на некоторые силициды:
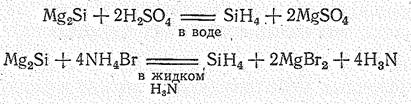
В последнем случае роль кислоты играет NН4Вr. Разложение силицидов кислотами в жидком аммиаке приводит к большему выходу продуктов, чем при разложении в водной среде.
Поскольку связи типа р p— р p для кремния не характерны, гидриды с двойными и тройными связями между атомами кремния — аналоги этилена, ацетилена и бензола неизвестны.
Диоксид кремния SiO2 (кремнезем, кремний) имеет несколько модификаций. В природе он встречается главным образом виде минерала кварца (гексагональная структура), а также кристобалита (кубическая структура) и тридимита (гексагональная структура). Модификации SiO2 отличаются характером расположения кремнекислородных тетраэдров SiO4 в пространстве.
Кремнезем тугоплавок (Тпл.1713 °С, Ткип. 2590 оС), очень тверд и химически стоек. На него действует лишь фтор, плавиковая кислота и газообразный НF, а также растворы щелочей и фосфорная кислота. В воде в обычных условиях SiО2 не растворяется, но начиная со 150 °С его растворимость возрастает, достигая 0,25 % при 500 °С.
Кремнезем легко переходит в стеклообразное состояние. В отличие от кристаллических модификаций SiО2 в кварцевом стекле тетраэдрические структурные единицы SiO4 расположены неупорядоченно. Кварцевое стекло химически и термически весьма стойко. Его применяют для изготовления химической аппаратуры и в оптических приборах.
Аморфный кремнезем является также основой ряда минералов: халцедона, опала, агата и др. Кварцевый песок в огромных количествах используется в производстве стекла, цемента, фарфора и пр.
При сверхвысоком давлении и нагревании (~1,2×I010 Па; ~1300 °С) была получена особая модификация SiО2, названная стишовитом. Его плотность на 60% выше плотности кварца. Это объясняется тем, что стишовит имеет в нем координационное число 6. Благодаря плотной структуре стишовит еще менее активен, чем кварц. Он устойчив даже к концентрированному раствору плавиковой кислоты.
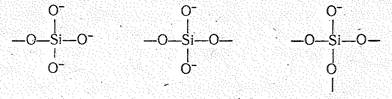 Структурной единицей оксосиликатов, как и SiО2, является тетраэдрическая группировка атомов SiО4. Два соседних кремнекислородных тетраэдра SiО4 соединены друг с другом только через один атом кислорода. Если в кристаллах SiО2 (координационная решетка) каждый SiО4-тетраэдр дает на образование связей Si—О—Si четыре вершины, то в оксосиликатах могут давать три, две или одну вершину:
Структурной единицей оксосиликатов, как и SiО2, является тетраэдрическая группировка атомов SiО4. Два соседних кремнекислородных тетраэдра SiО4 соединены друг с другом только через один атом кислорода. Если в кристаллах SiО2 (координационная решетка) каждый SiО4-тетраэдр дает на образование связей Si—О—Si четыре вершины, то в оксосиликатах могут давать три, две или одну вершину:
Этим объясняется большое разнообразие возможных способов сочетаний друг с другом SiО4-тетраэдров, структур и типов оксосиликатов. Так, в системе СаО — SiО2 возможны следующие соединения: Са2SiО4, Са3Si2О7, СаSiО3.
При нагревании эквимолярной смеси СаО + SiO2 при 1000 — 1200 °С вначале образуется Са2SiО4, затем Са3Si2О7 и, наконец, СаSiO3.
Тетраэдры SiО4, как и РО4, могут объединяться попарно (Si2О76-), в замкнутые кольца из трех (Si3O96-), четырех (Si4О128-), шести (Si6О1812-) тетраэдров.
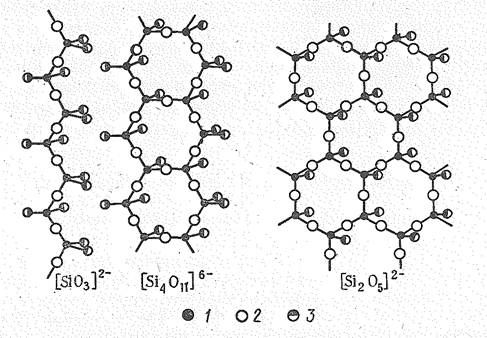
| Рис. 1. Полимерные оксосиликатные ионы: 1 – атом кремния, 2 - мостиковый атом кислорода, 3 – концевой атом кислорода. |
Эти относительно простые структурные единицы в свою очередь могут объединяться в полимерные цепочки, ленты, сетки.
Цепи, ленты и слои связаны между собой расположенными между ними катионами. В зависимости от типа оксосиликатных анионов силикаты имеют волокнистую (асбест), слоистую (слюда) структуру.
Кроме силикатов в природе широко распространены алюмосиликаты, в образовании которых наряду с тетраэдрами SiO4 принимают участие тетраэдры АlO4.
Большинство оксосиликатов нерастворимо в воде. Исключение составляют силикаты s -элементов I группы. Силикаты натрия и калия получают кипячением SiО2 в растворе щелочи. При этом образуется смесь оксосиликатов, которой приписывается общая формула Nа2SiO3 или К2SiО3. Концентрированный раствор силиката натрия, называемый жидким (или растворимым) стеклом, применяется в производстве негорючих тканей, для пропитки древесины, в качестве клея и т. д.
Для оксосиликатов, как и для SiO2, очень характерно стеклообразное состояние. Обычное стекло получают сплавлением смеси соды (или Nа2SО4), известняка и кварцевого песка. При этом образуется стекло приблизительного состава Nа2О×СаО×6SiO2, состоящее из больших полимерных анионов; оно нерастворимо, химически неактивно. Обыкновенное стекло в той или иной степени окрашено в зеленый цвет содержащимися в нем силикатами железа.
Для придания стеклу тех или иных физико-химических свойств (прозрачности, химической, термической и механической прочности и пр.) вводятся соответствующие добавки, изменяющие состав и структуру стекол, Так, у стекла, содержащего вместо натрия калий (калиевое стекло), температура размягчения выше, чем у обычного натриевого стекла, поэтому оно используется для изготовления специальных лабораторных приборов. Замена кальция на свинец, а натрия на калий придает стеклу повышенный показатель преломления, большую плотность. Из свинцового стекла (хрусталя) изготовляют вазы, фужеры и пр. добавление к стеклу соединений кобальта придает им синюю окраску, Сr2О3 — изумрудно-зеленую, соединений марганца фиолетовую окраску и т. д. Существенно изменяются свойства стекол, содержащих В2О3.
Стекло химически очень стойко, но хрупко, что препятствует широкому применению его для изготовления труб и аппаратуры химический производств. В последнее время прочность стекол повышают, придавая им мелкокристаллическую. структуру. В результате управляемой кристаллизации расплавленных стекол удается получить очень мелкокристаллические однородные материалы — ситаллы (стеклокристаллы), прочность которых иногда более чем в 5 раз превышает прочность исходных стекол и приближается к прочности чугуна.
Поскольку SiO2 с водой практически не взаимодействует, кремневые кислоты могут быть получены только косвенным путем: действием кислот на растворы оксосиликатов или гидролизом некоторых соединений Si+4 (галогенидов, сульфида, эфиров ортокремневой кислоты и др.). При гидролизе, например, SiS2 вначале получается ортокремневая кислота Н4SiО4 (К1 = 2×10-10, К2 = 2×10-12):
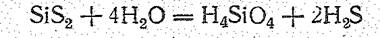
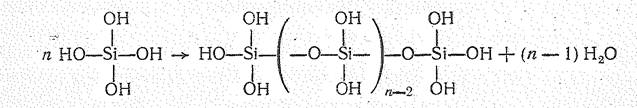 Она растворима в воде, но при стоянии более или менее быстро полимеризуется:
Она растворима в воде, но при стоянии более или менее быстро полимеризуется:
Подобным же образом могут взаимодействовать срединные группы ОH, образуя разветвленные и трехмерные макромолекулы.
Переход ортокремневой кислоты в поликислоты сопровождается превращением молекулярного раствора Н4SiО4 в коллоидные растворы — золи. Золи в свою очередь либо застудневают целиком, т. е. превращаются в гель, либо выпадают в виде объемистых осадков, включающих большое количество воды. Состав получаемых кремневых кислот сильно зависит от исходных веществ и условий проведения реакций.
Нагревая осадки поликремневых кислот, постепенно их обезвоживая, можно получить тонкодисперсный SiO2 — силикагель, который применяется в качестве адсорбента.
Дисульфид кремния SiS2 получают сплавлением аморфного кремния с серой в отсутствие воздуха или по реакции (при 1З00 °С)
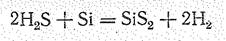
Возогнанный в вакууме дисульфид выделяется в виде белых шелковистых игл (Тпл. 1090 °С, Ткип. 1130 °С). Как показывает рентгеноструктурный анализ, иглы эти слагаются из полимерных цепей, в которых SiS4-тетраэдры объединены ребрами.
SiS2 значительно активнее SiO2. В частности, SiS2 разлагается водой. С основными сульфидами при сплавлении образует сульфидосиликаты (тиосиликаты).
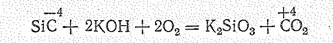 Карбид кремния SiС (карборунд), подобно углероду и кремнию, существует в виде кубической (алмазоподобной) и гексагональной модификаций. В чистом виде алмазоподобный SiС — диэлектрик, но с примесями становится полупроводником (DЕ 1,5—3,5 эВ) с n - или р -проводимостью. Он тугоплавок (Тпл. 2830 °С), по твердости близок к алмазу, химически весьма стоек. Разрушается лишь при нагревании в смеси НF + НNО3 и при сплавлении со щелочами в присутствии окислителя, например:
Карбид кремния SiС (карборунд), подобно углероду и кремнию, существует в виде кубической (алмазоподобной) и гексагональной модификаций. В чистом виде алмазоподобный SiС — диэлектрик, но с примесями становится полупроводником (DЕ 1,5—3,5 эВ) с n - или р -проводимостью. Он тугоплавок (Тпл. 2830 °С), по твердости близок к алмазу, химически весьма стоек. Разрушается лишь при нагревании в смеси НF + НNО3 и при сплавлении со щелочами в присутствии окислителя, например:
Карбид кремния получают в дуговых электропечах (при 2000—2200 °С) из смеси кварцевого песка и кокса. SiС широко применяется как абразивный и огнеупорный материал, его кристаллы используются в радиотехнике.
Большой химической стойкостью и жаропрочностью обладает также нитрид кремния Si3N4. Это твердый тугоплавкий белый порошок (Твозг. ~1900 °С). Он очень устойчив к химическим воздействиям НF, растворов щелочей, металлов. Кристаллы Si3N4 бесцветны, проявляют полупроводниковые свойства (DЕ = 3,9 эВ). Нитрид кремния используют в качестве химически стойкого и огнеупорного материала, в создании коррозионностойких и тугоплавких сплавов, в качестве высокотемпературного полупроводника.
Кроме неорганических соединений кремния большое значение имеют кремнийорганические соединения. Кремнийорганические соединения — представители более широкого класса так называемых элементоорганических соединений. Полимерные элементоорганические соединения сочетают термическую стойкость, присущую неорганическим материалам, с рядом свойств полимерных органических веществ.

|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 250; Нарушение авторских прав?; Мы поможем в написании вашей работы!